
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是

A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 夜间无光照时,a电极流出电子
D. 光照时,b极反应式是VO2++2OH--e-=VO2++H2O
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )
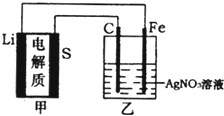
A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如图所示。放电时总反应为Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。电解质为含
4Al2Cl7-+3Cn(Cn表示石墨)。电解质为含![]() 的熔融盐,下列说法正确的是
的熔融盐,下列说法正确的是![]()
![]()

A.放电时负极反应为![]()
B.放电时![]() 移向正极
移向正极
C.充电时阳极反应为![]()
D.电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组设计如图所示装置,进行NO和![]() 假设二者物质的量之比为
假设二者物质的量之比为![]() 的处理并制取硝酸。下列说法正确的是
的处理并制取硝酸。下列说法正确的是![]()

A.ab适宜选用阴离子交换膜
B.该电池工作时,正极区溶液的pH减小
C.导线中流过![]() 电子的电量时,有
电子的电量时,有![]() 离子通过交换膜
离子通过交换膜
D.负极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:I2(g)+H2(g)![]() 2HI(g),已知I2、H2、HI的起始浓度分别为0.1molL-1 、0.3molL-1、0.2molL-1,一定条件下当反应达到平衡时,各物质的浓度有可能是
2HI(g),已知I2、H2、HI的起始浓度分别为0.1molL-1 、0.3molL-1、0.2molL-1,一定条件下当反应达到平衡时,各物质的浓度有可能是
A.H2为0.15molL-1B.HI为0.35molL-1
C.I2为0.2molL-1D.HI为0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:
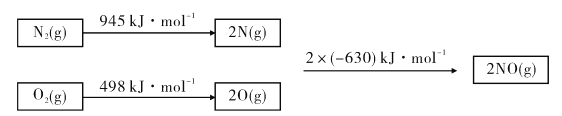
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
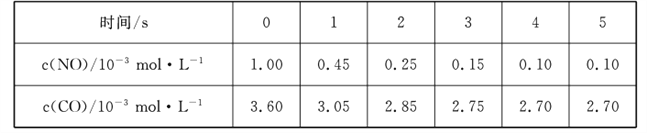
①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
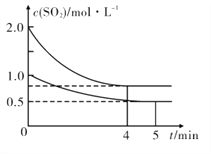
A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。
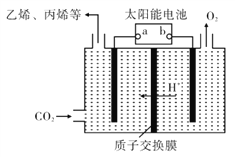
①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com