
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )
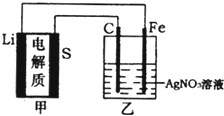
A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E、F、G均为有机化合物。
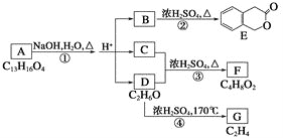
根据上图回答问题:
(1)D、F的化学名称是_______________、_________________。
(2)写出下列反应的化学方程式,并注明反应类型。
②__________,_______________;
④_________,________________。
(3)A的结构简式是_____________,1 mol A与足量的NaOH溶液反应会消耗_____________mol NaOH。
(4)符合下列3个条件的B的同分异构体的数目有__________个。
①含有邻二取代苯环结构
②与B有相同官能团
③不与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.用排饱和食盐水法收集氯气
B.加压条件有利于N2和H2反应生成NH3
C.将盛有NO2的球浸泡在热水中颜色加深
D.加催化剂,使N2和H2在一定的条件下转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日诺贝尔化学奖颁给三位科学家,以表彰他们在锂离子电池领域的贡献。用镁代替锂可增加电池的能量密度,一种镁电池的总反应如下:![]() ,用该电池在碳棒上镀铜装置如图,下列说法正确的是
,用该电池在碳棒上镀铜装置如图,下列说法正确的是![]()
![]()
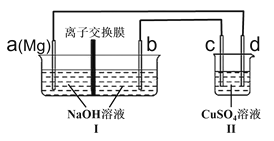
A.装置Ⅰ放电时的b电极反应式为:![]()
B.装置II中d极是碳棒,接通电路后,硫酸铜溶液浓度减小
C.装置I中最适合用阴离子交换膜,![]() 向b极移动
向b极移动
D.若用阴离子交换膜,有![]() 通过时,消耗镁12g
通过时,消耗镁12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左图,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(右图)作为电源。有关说法不正确的是
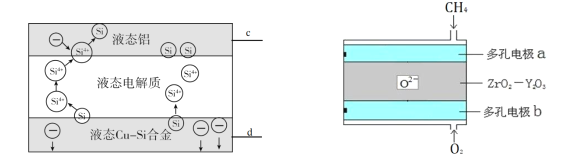
A. 电极c与a相连,d与b相连
B. 左侧电解槽中:Si 优先于Cu被还原,Cu优先于Si被氧化
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 相同时间下,通入CH4、O2的体积不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是

A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 夜间无光照时,a电极流出电子
D. 光照时,b极反应式是VO2++2OH--e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 H2O,溶液中的C(NH4 +)由大到小的顺序是__________________(用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
Ka1 | Ka2 | |
H2SO3 | 1.3x10-2 | 6.3x10-8 |
H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀;当体系中两种沉淀共存时,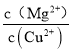 =_______。
=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com