
����Ŀ�����ڻ�ѧ��ҵ������Ҫ��Ӧ�ã���ش��������⡣
(1)�����ӷ���ʽ��ʾFeCl3������ˮ����ԭ��:______________________________��
(2)�����£���pH=3��������pH =11��Na2S��Һ�У�ˮ���������c(OH-)֮��Ϊ_______
(3)���ʵ���Ũ����ȵ�������Һ��NH4Cl��NH4 HSO4�ۣ�NH4 ) 2SO4��CH3 COONH4��NH3 H2O����Һ�е�C(NH4 +)�ɴ�С��˳����__________________(����ű�ʾ����
(4)25����������ĵ���ƽ�ⳣ�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3x10-2 | 6.3x10-8 |
H2CO3 | 4.2x10-7 | 5.6x10-11 |
��0.10 mol L-1NaHSO3��Һ������Ũ���ɴ�С��˳��Ϊ__________________
����NaHCO3��Һ��ͨ��������������ʱ��Ӧ�����ӷ���ʽΪ__________________________
(5)��֪ 25 �� ʱ Ksp[Mg(OH)2] =1.8��10-11, Ksp[Cu(OH)2] =2.2 ��10-20.25 ��ʱ����Ũ�Ⱦ�Ϊ0.1 mol L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������________(�ѧʽ������;����ϵ�����ֳ�������ʱ��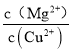 =_______��
=_______��
���𰸡�Fe3++3H2O![]() Fe(OH)3(����)+3H+ 1��108 �ۣ��ڣ��٣��ܣ��� c(Na+)��c(HSO3��)��c(H+)��c(SO32��)��c(OH��) SO2+HCO3��===HSO3��+CO2 Cu(OH)2 8.2��108
Fe(OH)3(����)+3H+ 1��108 �ۣ��ڣ��٣��ܣ��� c(Na+)��c(HSO3��)��c(H+)��c(SO32��)��c(OH��) SO2+HCO3��===HSO3��+CO2 Cu(OH)2 8.2��108
��������
(1)Fe3+����ˮ�����ɾ��н�ǿ�����Ե�Fe(OH)3���壻
(2)�����е�������ȫ����ˮ���룬Na2S��Һ��ˮ�������������ȫ����ˮ���룻
(3)��Ԫ�����笠�����Ũ�����������һԪ�����ˮ�������Ƶģ���������һԪ����Ӳ���Ӱ��ģ�Ȼ����һԪ�����ˮ���ܴٽ��ģ����һԪ���ˮ���ɴ˷������
(4)���ж�NaHSO3�ĵ���̶ȴ���ˮ��̶ȴ����ж���Һ������Ũ�ȴ�С��ϵ��
(5)�ṹ������ͬ�ij����ܶȻ�ԽС�ܽ��ԽС�� Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)��Ksp[Cu(OH)2] = c(Cu2+)c2(OH-)���ݴ˼��㣻
(1)Fe3+����ˮ�����ɾ��н�ǿ�����Ե�Fe(OH)3���壬��Ӧ�����ӷ���ʽΪ��Fe3++3H2OFe(OH)3(����)+3H+��
(2)�����£���pH=3��������Һ��ˮ�����������������Ũ��c(OH-)=![]() =10-11��pH=11��Na2S��Һ��ˮ�����������������Ũ��c(OH-)=
=10-11��pH=11��Na2S��Һ��ˮ�����������������Ũ��c(OH-)=![]() =10-3mol/L��ˮ���������c(OH-)֮��=10-11��10-3=1��108���ʴ�Ϊ��1��108��
=10-3mol/L��ˮ���������c(OH-)֮��=10-11��10-3=1��108���ʴ�Ϊ��1��108��
(3)��Ԫ�����笠�����Ũ�����������һԪ�����ˮ�������Ƶģ���������һԪ����Ӳ���Ӱ��ģ�Ȼ����һԪ�����ˮ���ܴٽ��ģ����һԪ���ˮ��������Һ�е�c(NH4+)�ɴ�С��˳���Ǣۣ��ڣ��٣��ܣ��ݣ��ʴ�Ϊ���ۣ��ڣ��٣��ܣ��ݣ�
(4)��0.10molL-1NaHSO3��Һ��HSO3-ˮ��ƽ�ⳣ��=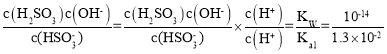 <Ka2��˵��������������ӵ���̶ȴ�����ˮ��̶���Һ�����ԣ����Ե���̶ȴ���ˮ��̶ȣ��������Ũ�ȴ�СΪc(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��
<Ka2��˵��������������ӵ���̶ȴ�����ˮ��̶���Һ�����ԣ����Ե���̶ȴ���ˮ��̶ȣ��������Ũ�ȴ�СΪc(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��
��ͼ�������ݱȽϵõ�������H2SO3��H2CO3��HSO3-��HCO3-����NaHCO3��Һ��ͨ��������������ʱ��Ӧ���ɶ�����̼����Ӧ�����ӷ���ʽΪ��SO2+HCO3-=HSO3-+CO2��
(5)Mg(OH)2��Cu(OH)2�Ľṹ������ͬ��Cu(OH)2�ܶȻ���С���ܽ��ԽС��������ͬ��Ũ�ȵİ�ˮ��Cu(OH)2����������Cu(OH)2����������ʱ����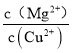 =
=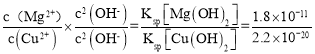 =8.2��108��
=8.2��108��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬�������һ�����͵�أ��������ܶ�ԼΪһ������豸�й㷺ʹ�õ�����ӵ�ص�4�����ҳɱ�����������֪����ص��ܷ�ӦΪ![]() ���ô˵������Դ���������
���ô˵������Դ���������![]() ��Һ���乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
��Һ���乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
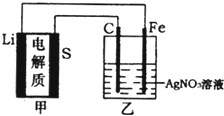
A.�ҳ���Һ�е�NO3![]() �������缫
�������缫
B.�ҳ�ʯī�缫��ӦʽΪ![]()
C.�׳س��ʱ��﮵缫����������Ӧ
D.�׳�������14gﮣ��ҳ��в���![]() ����
����![]() ��״����
��״����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ��������һ�����͵ĸ߱�����п-����Һ����أ��乤��ԭ��ʾ��ͼ���¡�ͼ����Һ���ɴ���������Һ����ߵ�ص�������������������ȷ����

A. �ŵ�ʱ��a�缫��ӦΪ
B. �ŵ�ʱ����Һ�����ӵ���Ŀ����
C. ���ʱ��b�缫ÿ����![]() ����Һ����
����Һ����![]() ������
������
D. ���ʱ��a�缫�����Դ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ��I2(g)+H2(g)![]() 2HI(g)����֪I2��H2��HI����ʼŨ�ȷֱ�Ϊ0.1molL-1 ��0.3molL-1��0.2molL-1��һ�������µ���Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
2HI(g)����֪I2��H2��HI����ʼŨ�ȷֱ�Ϊ0.1molL-1 ��0.3molL-1��0.2molL-1��һ�������µ���Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
A.H2Ϊ0.15molL-1B.HIΪ0.35molL-1
C.I2Ϊ0.2molL-1D.HIΪ0.4molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ10L���ܱ������У��������·�Ӧ��A(g)+2B(g)![]() C(g)+D(g)���������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ1��
C(g)+D(g)���������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ1��
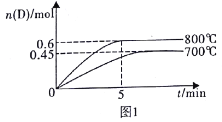
�Իش��������⣺
(1)���ж�������Ӧ�ﵽ��ѧƽ��״̬��������________________����д��ĸ��
A.����ѹǿ����
B.���������c(A )����
C.2v (B ) =v (D ) D.c(A) =c(C)
(2)����ͼ1�����ݼ���800��ʱ��ƽ�ⳣ��K=______________��
(3)700��ʱ��ijʱ�̲����ϵ�и����ʵ������£�n��A)=1.1mol��n��B��=2.6mol��n��C��=0.9mol��n��D��=0.9mol�����ʱ�÷�Ӧ____________������������Ӧ����������������淴Ӧ�����������������ƽ��״̬����
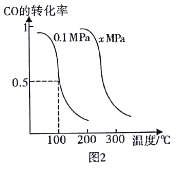
(4)�ڴ��������£�CO�����ںϳɼ״�CO(g)+2H2(g)=CH3OH(g),���ں��º�ѹ�������£����ܱ������г���4molol CO��8molH2�ϳɼ״���ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��
�ٸ÷�Ӧ������Ӧ����_________��Ӧ��������������������������ͼ2��x_____0.1����������������С��������
����0.1 MPa��100��������£��÷�Ӧ�ﵽƽ��ʱ��������������ʵ���Ϊ_______mol��
�����ں��º��ݵ������£�������ƽ����ϵ�г���4mol CO��8 mol H2����ԭƽ�����,�ﵽƽ��ʱCO��ת����_______(����������,������������С������ͬ����ƽ�ⳣ��K_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У��׳ص��ܷ�ӦʽΪ2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O���Իش�:
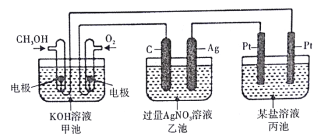
(1)ͼ�м׳ص�װ����_________������ԭ���������������)���ҳ���ʯī�缫��________����
(2)д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ��________________
(3)�ҳ����ܷ�Ӧ�Ļ�ѧ����ʽΪ___________________
(4)���ҳ���Ag������������5.40gʱ���׳�������������O2________mL����״��������ʱ����ij�缫������1.60gij������������е�����Һ������________������ĸ��
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.��Ӧ��������������������������ʱ���÷�Ӧһ�����ܷ���
B.ǿ���ǿ�Ӧ�ų�������һ�����к���
C.��ʯī�Ƚ��ʯ�ȶ���֪��C(���ʯ��s)===C(ʯī��s) ��H<0
D.��101 kPa��25��ʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ�ɱ�ʾΪ�� 2 H2(g)��O2(g)===2 H2O(l) ��H����571.6 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ķ���COx��NOx��SOx�Ի����к������ܺ������������գ����Լ�����Ⱦ�����Ϊ����
(1)��֪�����ȼ����Ϊ890 kJ/mol��1 molˮ�������Һ̬ˮ����44 kJ��N2��O2��Ӧ����NO�Ĺ������£�
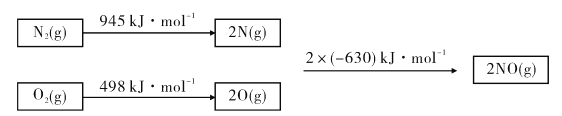
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=_______.
(2)����β���к���CO��NO��ij�о�С�����÷�Ӧ��2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)ʵ������������ŷš�T1��ʱ���ں��ݵ��ܱ�������ͨ��һ������CO��NO�����Է�����������Ӧ����ò�ͬʱ���NO��CO��Ũ�����±���
N2 (g)+2CO2 (g)ʵ������������ŷš�T1��ʱ���ں��ݵ��ܱ�������ͨ��һ������CO��NO�����Է�����������Ӧ����ò�ͬʱ���NO��CO��Ũ�����±���
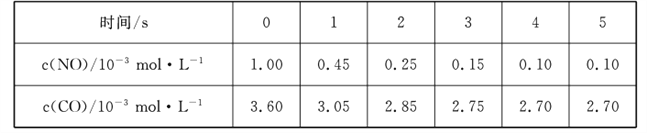
��0��2 s����N2��ʾ�Ļ�ѧ��Ӧ����Ϊ____�����¶��£���Ӧ��ƽ�ⳣ��K1_____��
�����÷�Ӧ�ھ��Ⱥ��������½��У���Ӧ�ﵽƽ�����ϵ���¶�ΪT2�棬��ʱ�Ļ�ѧƽ�ⳣ��ΪK2����K1____K2���>������<����=������ԭ����________
(3)��ס��������ݻ���Ϊ1 L�ĺ��º��ݵ��ܱ������У��ֱ����һ������SO2��O2(���У��׳���2 mol SO2��1 mol O2���ҳ���1 mol SO2��0.5 mol O2)��������Ӧ��2SO2(g)+O2 (g) ![]() 2SO3 (g) ��H= -197. 74 kJ/mol ��һ��ʱ���ﵽƽ�⣬�����������c(SO2)(mol/L)��ʱ��t(min)�ı仯��ϵ����ͼ��ʾ������˵����ȷ����______
2SO3 (g) ��H= -197. 74 kJ/mol ��һ��ʱ���ﵽƽ�⣬�����������c(SO2)(mol/L)��ʱ��t(min)�ı仯��ϵ����ͼ��ʾ������˵����ȷ����______
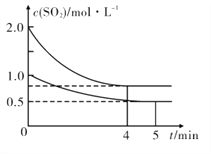
A���ų�������Q:Q(��)>2Q���ң�
B����ϵ��ѹǿp��p���ף�>2p(��)
C���������ﵽ��ѧƽ��ʱ���仯ѧƽ�ⳣ��Ϊ4
D�����������������䣬����ʼʱ�����г���0.4 mol SO2��0.2mol O2��0.4 molSO3�����ʱv(��>v(��)
(4)��ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ������ͼ��ʾ��
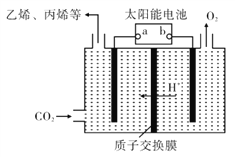
�ٸù���������ת����ʽ��Ҫ��____��
�ڵ��ʱ��������ϩ�ĵ缫��Ӧʽ��____��
(5)CO2����Ȼ��ѭ��ʱ����CaC03��Ӧ��Ca-CO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2 CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2 CO3��Һ��ϣ���Na2 C03��Һ��Ũ��Ϊ2��10-4 mol��L�������ɳ�������CaCl2��Һ����СŨ��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com