
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是 .
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | ||
t1 | t2 | △H | ||
① | 50 mL0.55 molL﹣1NaOH溶液 | 20℃ | 23.3℃ | |
50 mL0.5 molL﹣1HCl溶液 | ||||
② | 50 mL0.55 molL﹣1NaOH溶液 | 20℃ | 23.5℃ | |
50 mL0.5 molL﹣1HCl溶液 | ||||
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 各物质的密度均为1gcm﹣3 .
①计算完成上表△H=(保留2位小数).
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: .
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果填“有”或“无”)影响.
【答案】
(1)量筒;温度计
(2)不能;金属易导热,热量散失导致误差大
(3)﹣56.85;HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣56.8kJ?mol﹣1
(4)无;有
【解析】解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒;所以答案是:量筒;温度计;(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大,所以答案是:不能;金属易导热,热量散失导致误差大;(3)①第1次实验反应前后温度差为:3.3℃,第2次实验反应前后温度差为:3.5℃,平均温度差为3.4℃,50 mL0.55 molL﹣1NaOH溶液与50 mL0.5 molL﹣1HCl溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量为:1.4212kJ,所以生成1mol的水放出热量为: ![]() =56.85kJ,即该实验测得的中和热△H=﹣56.85kJ/mol; 所以答案是:﹣56.85;②稀盐酸和NaOH稀溶液反应生成1mol水放热56.8KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣56.8kJmol﹣1;所以答案是:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣56.8kJmol﹣1;(4)KOH代替NaOH都是强碱,符合中和热的概念,所以用KOH代替NaOH,对测定结果无影响;醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,但△H偏大;
=56.85kJ,即该实验测得的中和热△H=﹣56.85kJ/mol; 所以答案是:﹣56.85;②稀盐酸和NaOH稀溶液反应生成1mol水放热56.8KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣56.8kJmol﹣1;所以答案是:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣56.8kJmol﹣1;(4)KOH代替NaOH都是强碱,符合中和热的概念,所以用KOH代替NaOH,对测定结果无影响;醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,但△H偏大;
所以答案是:无;有.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: 
(1)铜与稀硝酸反应的离子方程式 .
(2)能否在I实验装置中用铜与稀硝酸反应制的较为纯净的NO气体(填“能”或“不能”),简述理由 .
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是
在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象 . 反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是 .
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
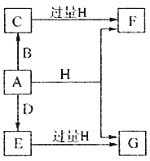
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应 2AB+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据表中数据完成下列填空:
(1)在实验1,反应在10至20min内的平均速率为mol/(L.min)
(2)在实验2,A的初始浓度C2=mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为υ3 , 实验1的反应速率为υ1 , 则υ3υ1(填“<“,“=“,“>“),且C31.0mol/L (填“<“,“>“或“=“).
(4)比较实验4和实验1,可推测该反应反应(填“吸热“或”放热“),理由是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)xC(g)△H未知,如图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 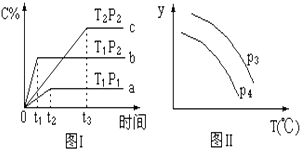
A.P3<P4 , y轴表示A的转化率
B.P3<P4 , y轴表示B的体积分数
C.P3<P4 , y轴表示混合气体的密度
D.P3>P4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2 ![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH2═CH2+HBr→CH3CH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH ![]() H3COOCH2CH3+H2O
H3COOCH2CH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com