
����Ŀ����������ṹ�����Ŀ��
��1���ù��ʾ��ͼ��ʾFe3+�ļ۵����Ų� ��
��2��ij����Ԫ�صĵ����ܣ����ӷ��أ����£�
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
�жϸ�Ԫ�ش����壻
��3����ABn������ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ����ü۲���ӶԻ���ģ�ͣ�����˵����ȷ����������ĸ����
A.��n=2������ӵ����幹��ΪV��
B.��n=3������ӵ����幹��Ϊ������
C.��n=4������ӵ����幹��Ϊ����������
D.����˵��������ȷ
��4���������ӵĽṹ��ͼ1����V�ͣ�����116.5�㣮��ش𣺢ٳ����������Ĺ�ϵ�� ��
�����з�����������ӵĽṹ�����Ƶ���������ĸ����
A��H2O B��CO2 C��SO2 D��BeCl2
�۳��������Ƿ�Ϊ���Է�������ǡ�����
��5���ڶ�����Ԫ���У�������Ԫ����ɵļ������Ӽ����й��ۼ�����λ�����������������������������8���������ʵĵ���ʽ ��
��6��������Ϊ�������ܶѻ��ṹ������ѵ�ԭ�Ӱ뾶Ϊr�������ṹ��ͼ2��ʾ����þ����ı߳�a= �� b=���ú�r�Ĵ���ʽ��ʾ��
���𰸡�
��1��![]()
��2��VA
��3��C
��4��ͬ�������壻C����
��5��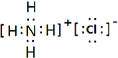
��6��2r��![]() r
r
���������⣺��1��Fe3+�ļ۵���Ϊ3d5 �� ���ݺ��ع���ͱ���������ԭ��������ʾ��ͼΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2����Ԫ�ص��������ܾ�������Ԫ��ԭ������������Ϊ5������VA�壬���Դ��ǣ�VA����3�����ݼ۲���ӶԻ�������֪����ABn�ͷ��ӵ�����ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ���n=2������ӵ����幹��Ϊֱ���Σ���n=3������ӵ����幹��Ϊƽ�������Σ���n=4������ӵ����幹��Ϊ���������Σ���ѡ��C����4����O2��O3��������Ԫ���γɵIJ�ͬ���ʣ���Ϊͬ�������壬���Դ��ǣ�ͬ�������壻�ڶ�����̼��BeCl2Ϊֱ���ͣ�ˮΪV�νṹ���������ڴ�м����ڳ���O3�У����ĵ���ԭ����sp2�ӻ��������Ե���λ��ԭ�Ӽ������������Ҽ���ʹO3���ӳ������Σ���������ԭ��֮�仹������һ����ֱ�ڷ���ƽ��Ĵ�м����������Ħм��������ĵ���ԭ���ṩ����p���ӡ�����������λ��ԭ�Ӹ��ṩһ��p�����γɵģ�SO2���ӳʡ�V�����νṹ����ɼ���ʽ��O3���ƣ�Sԭ��sp2�ӻ���Sԭ�Ӻ��������ԭ�ӳ��ԦҼ�������⣬���γ�һ���������ĵ��ӵĴ�м�����ѡ��C����O3�е�����Oԭ��Ϊsp2�ӻ�������ģ��Ϊƽ�������Σ����ӹ���ΪV�ͣ�����O3�γɵ����������ĵ��Ӵ�м����ռ乹�Ͳ��Գƣ�����������IJ��غϣ������Ǽ��Է��ӣ����Դ��ǣ��ǣ���5�������ַǽ���Ԫ���γɵ���֦������Һ��й��ۼ���ӦΪ��Σ������������������������8����ӦΪ�Ȼ�泥���ѧʽΪNH4Cl������ʽΪ
����2����Ԫ�ص��������ܾ�������Ԫ��ԭ������������Ϊ5������VA�壬���Դ��ǣ�VA����3�����ݼ۲���ӶԻ�������֪����ABn�ͷ��ӵ�����ԭ��A��û��δ�����γɹ��ۼ��ŶԵ��ӣ���n=2������ӵ����幹��Ϊֱ���Σ���n=3������ӵ����幹��Ϊƽ�������Σ���n=4������ӵ����幹��Ϊ���������Σ���ѡ��C����4����O2��O3��������Ԫ���γɵIJ�ͬ���ʣ���Ϊͬ�������壬���Դ��ǣ�ͬ�������壻�ڶ�����̼��BeCl2Ϊֱ���ͣ�ˮΪV�νṹ���������ڴ�м����ڳ���O3�У����ĵ���ԭ����sp2�ӻ��������Ե���λ��ԭ�Ӽ������������Ҽ���ʹO3���ӳ������Σ���������ԭ��֮�仹������һ����ֱ�ڷ���ƽ��Ĵ�м����������Ħм��������ĵ���ԭ���ṩ����p���ӡ�����������λ��ԭ�Ӹ��ṩһ��p�����γɵģ�SO2���ӳʡ�V�����νṹ����ɼ���ʽ��O3���ƣ�Sԭ��sp2�ӻ���Sԭ�Ӻ��������ԭ�ӳ��ԦҼ�������⣬���γ�һ���������ĵ��ӵĴ�м�����ѡ��C����O3�е�����Oԭ��Ϊsp2�ӻ�������ģ��Ϊƽ�������Σ����ӹ���ΪV�ͣ�����O3�γɵ����������ĵ��Ӵ�м����ռ乹�Ͳ��Գƣ�����������IJ��غϣ������Ǽ��Է��ӣ����Դ��ǣ��ǣ���5�������ַǽ���Ԫ���γɵ���֦������Һ��й��ۼ���ӦΪ��Σ������������������������8����ӦΪ�Ȼ�泥���ѧʽΪNH4Cl������ʽΪ 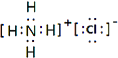 �����Դ��ǣ�
�����Դ��ǣ� 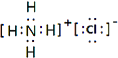 ����6���ϵ������ϵ�ԭ�����ڣ����Եó���a=2r���ڲ�ԭ�����ϵ��桢���µ���3��ԭ�������Ҿ��γ���������ṹ����bΪ��������ߵ�2��������������ⳤΪ2r����������������Ϊ2r��
����6���ϵ������ϵ�ԭ�����ڣ����Եó���a=2r���ڲ�ԭ�����ϵ��桢���µ���3��ԭ�������Ҿ��γ���������ṹ����bΪ��������ߵ�2��������������ⳤΪ2r����������������Ϊ2r�� ![]() =
= ![]() r���������ĵ��ߵľ���Ϊ
r���������ĵ��ߵľ���Ϊ ![]() r��
r�� ![]() ���ɹ��ɶ�����֪��������ĸ�Ϊ
���ɹ��ɶ�����֪��������ĸ�Ϊ ![]() =
= ![]() r����b=2��
r����b=2�� ![]() r=
r= ![]() r�����Դ��ǣ�2r��
r�����Դ��ǣ�2r�� ![]() r��
r��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ�أ�ԭ��������������Aԭ�ӵ����������4�����ӣ�B�������Ӻ�C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ����Ԫ�صĵ��ʷ�Ӧ������һ�ֵ���ɫ�Ĺ���E��D��L�����������K��M�������Ӳ��ϵĵ�����֮�ͣ�
��1��AΪ �� BΪ �� CΪ ��
��2��E�ĵ���ʽΪ ��
��3��д��D������������ˮ�����A���ʷ�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶Ȳ�����ݵ�������0.1molL��1H2���з�ӦH22H����ij��ʱ����H2Ũ����0.06molL��1����0.036molL��1����ķ�Ӧʱ��Ϊ12s����Ӧ��ʼʱH2Ũ����0.1molL��1����0.06molL��1���ʱ��Ϊ�� ��
A.����24s
B.����20s
C.����20s
D.��20s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С������ͼװ��̽��SO2��Fe��NO3��3��Һ�ķ�Ӧ����֪��1.0molL��1��Fe��NO3��3��Һ��pH=1����ش��������⣺
��1���μ�Ũ����֮ǰ����ͨ������Ŀ���� �� Cװ�õ������� ��
��2����ַ�Ӧ����˵��SO2��Fe��NO3��3��Һ������Ӧ��ʵ�������� ��
��3��Ϊ̽��SO2��Fe��NO3��3��Һ������Ӧ��ԭ�������о�С��������²��룺����1��SO2��Fe3+��Ӧ��
����2��������������SO2��NO3����Ӧ��
����3��
��������1������װ��B�з�Ӧ�����ӷ���ʽ������Ҫ����Fe3+�Ƿ�ľ��������Լ��Ļ�ѧʽ�� ��
��������2������������ѡ�������Լ��е�������ĸ����SO2��Ӧ����һ����֤��
a��NaNO3��BaCl2�Ļ����Һ
b��FeCl3 �� NaNO3�Ļ����Һ
c��FeCl3��BaCl2�Ļ����Һ��
��4��SO2Ϊ������Ⱦ��о�С��Ϊ�ⶨij������������SO2�ĺ�����ȡ10m3����״���£�����������ͨ��������ˮ�У���������Һ�м��������BaCl2��Һ���������İ�ɫ����ϴ�ӡ�����Ƶ�����Ϊ0.4660g����˿�����SO2��Ũ��Ϊmgm��3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ������һ�ֳ������л�������ṹ��ʽΪ![]() ��
��
��1��ƻ������������������ŵ�������_______________��
��2��ƻ������ܷ����ķ�Ӧ��________(�����)��
�ټӳɷ�Ӧ ��������Ӧ �ۼӾ۷�Ӧ ��������Ӧ ����ȥ��Ӧ ��ȡ����Ӧ
��3������A  �����Ҷ�����Ӧ���ɰ�Ԫ��������д���˹��̵Ļ�ѧ����ʽ��______________________________________________��
�����Ҷ�����Ӧ���ɰ�Ԫ��������д���˹��̵Ļ�ѧ����ʽ��______________________________________________��
��4��д��ƻ������Ũ��������������ᷴӦ�Ļ�ѧ����ʽ_______________________����Ӧ����Ϊ_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L������X��Y��Z�������ʵ����ʵ�����ʱ��仯����
��ͼ��ʾ����ͼ�����ݷ�����
��1���÷�Ӧ�Ļ�ѧ����ʽΪ
��2����Ӧ��ʼ��2min��Z��ƽ����Ӧ����Ϊ ��
��3��ƽ��ʱX���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������(����)
A.���������Բ�����ά��Ϊ��ǿ�塢�ϳ���֬������ĸ��ϲ���
B.�ɻ������ĸ��ϲ��ϴ�����Խ���Ϊ��ǿ�塢��άΪ����ĸ��ϲ���
C.�����������õĸ��ϲ������ںϳ���֬�Ļ����м�����̼��ά����ǿ��
D.����ɻ�������ʹ�õĸ����մ���������ά���մɸ��϶��ɵIJ����Ƴɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�����ա����ػ������������ʱ�����봩��10ǧ���صIJ��ں�����������ߡ��Ա�������ں���������ҹ���ѧ�ҽ��������Ƶ����͡�������ά���͡����ղ������ɣ�����Ҫ�ɷ�����̼���衢�մɺ�̼��ά���϶��ɵģ�������������������(����)
A.�����¡�������
B.���ȸ����ᡢӲ�����ʵؽϴ�
C.��û�й̶��۵�
D.����һ���������ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ϴ�ý[��Ҫ�ɷ�Ϊ����̿��ZnO��FeO����CH3COO��2Zn]����ȡ����п�����ʵ�鲽����ͼ��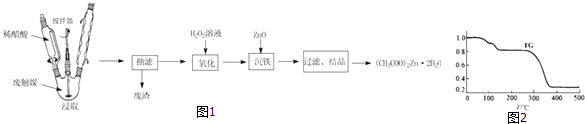
��1����ȡʱ����������ƿ�м���ϴ�ý��ϡ���ᣬ��������ƿ���Ȳ�ͬʱ������������Ŀ���� ��
��2�����Ƚ��ϴ�ý������¯��ͨ����500�洦��һ��ʱ�䣬�����ʻ�����ߣ���ԭ���� �� ����ʱ�õĹ��������������� ��
��3������ͼ�м���H2O2��Ŀ���� ��
��4�����þ��壨CH3COO��2Zn2H2O���ط�����TG/%=������Ʒ��ʣ������/������Ʒ����ʼ����������ͼ2�������ױ����ֽ�������Σ���200��C������ȥ�����ӽᾧˮ���γɵģ�CH3COO��2Zn��242��C���ڣ�370��C��ȫ�ֽ�ΪZnOͬʱ����CO2��һ�ֺ���������˴Ź�������ֻ��1��壩����CH3COO��2Zn�ֽ���������п�ķ�Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com