
【题目】已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:![]()
Ⅱ、25℃时有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:

(1)加入NaOH溶液时,反应的离子方程式为__________________;
(2)向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= ___________;
(3)“母液”中除了含有Na+、CO32-外,还含有_________等离子。
(4)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行_________(填“可行”或“不可行”),并说明理由__________________;
(5)已知:Na2CO310H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJmol-1
Na2CO310H2O(s)=Na2CO3H2O(s)+9H2O(g) △H=+473.63kJmol-1
写出Na2CO3H2O脱水反应的热化学方程式__________________;
【答案】(1)Fe3++3OH-=Fe(OH)3↓ MgCO3+2OH-=Mg(OH)2↓+CO32- (2) 2.125×1021 (3)Cl- 、SO42-
(4)不可行 若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质(5)Na2CO3H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol
【解析】
试题分析:(1)碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,发生的发应有:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH)2↓+CO32-;(2) 根据氢氧化镁和氢氧化铁的溶解平衡以及溶度积表达式,则当两种沉淀共存且溶液的pH=8时,c(Mg2+)=Ksp/[OH]2=5.61×1012/10125.61mol/L,c(Fe3+)= Ksp/[OH]3=2.64×1039/1018=2.64×10-21mol/L,所以 c(Mg2+):c(Fe3+)=5.61:2.64×10-21=2.125×1021;(3)原混合物中的Cl-和SO42-一直存在于 “母液”,故除了含有Na+、CO32-外,还含有Cl-和SO42-;(4)若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质,这样不符合该提纯工艺;(5)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3H2O(S)═Na2CO3(s)+H2O(g),即Na2CO3H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】取两种金属组成的混合物8.0 g,加入足量稀硫酸,反应后得到5.6 L标准状况下的气体,则混合物可能是( )
A. Al和Mg B. Al和Zn C. Fe和Cu D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液冲洗
B. 分馏实验,温度计应该在混合溶液中以便准确测量混合溶液的温度
C. 分液漏斗分液,放出下层液体后再从分液漏斗下口放出上层液体
D. 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金A由四种单质组成,已知:①合金A中不含K、Ca、Na;②气体B可燃;③气体G为人体新陈代谢的主要产物之一,请据图回答以下问题:

(1)合金A由哪些单质组成(用化学式表示):_____、_______、________、________;
(2)写出反应①的化学方程式:______________;
(3)写出反应②的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将m1 g样品加热,其质量变为m2 g,则该样品的纯度(质量分数)是( )
A. (84m2-53m1)/31m1×100% B. 84(m1-m2)/31m1×100% C. (73m2-42m1)/31m1×100% D. (115m2-84m1)/31m1×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘和CCl4,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
______________;该操作将I2还原为I-的主要目的是 ____________ 。
(2)操作X的名称为 ___。
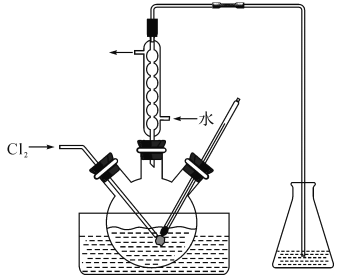
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_____________;锥形瓶里盛放的溶液为_______________
(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有 ___(化学式),②加入少量活性炭的目的是 ______ ,③操作Y的名称是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为____________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________________。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。

则相同条件下HX的电离平衡常数__________________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是____________________,稀释后,HX溶液中由水电离出来的c(H+)______________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)基态Mg原子L层电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PH4Cl的电子式为_________,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。

(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置中SO2的吸收效率,B中试剂是________,表明SO2吸收效率低的实验现象是B中溶液________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是_______、_______。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=12), 限用试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管、
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取ag KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液溶液的体积为vmL 则c(Na2S2O3溶液)=_______mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O ,2S2O32-+I2=S4O62-+2I- 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能_____(填“不受影响”、“偏低”或“偏高”) ,原因是________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com