
【题目】研究1-溴丙烷是否发生消去反应,用下图装置进行实验,观察到酸性高锰酸钾溶液褪色。下列叙述不正确的是
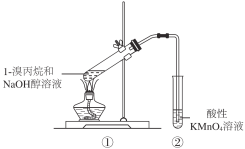
A. ②中一定发生了氧化还原反应
B. ①试管中也可能发生了取代反应
C. ①试管中一定发生了消去反应生成不饱和烃
D. 若②中试剂改为溴水,观察到溴水褪色,则①中一定发生了消去反应
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】H2(g)+2ICl(g)→2HCl(g)+I2(g)能量曲线如图。描述正确的是
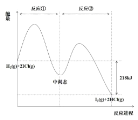
A.反应①为吸热反应
B.若加入催化剂可降低反应热
C.I2(g)+2HCl(g)的能量高于 I2(s)+2HCl(g)的总能量
D.热化学方程式为 H2(g)+2ICl(g)→2HCl(g)+I2(g)-218kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型 PAA( ![]() )具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
)具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
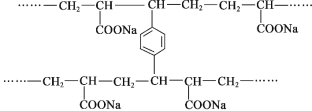
A.线型 PAA 的单体不存在顺反异构现象
B.形成网状结构的过程发生了加聚反应
C.交联剂 a 的结构简式是![]()
D.PAA 的高吸水性与—COONa 有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
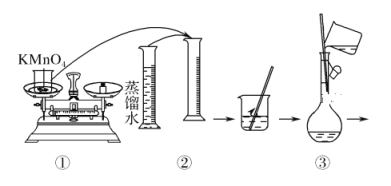
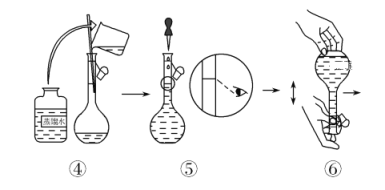
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
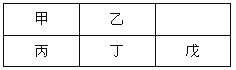
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500毫升.
(1)选用的主要仪器除了烧杯、玻璃棒、胶头滴管外还有:_______________(写两个)
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.稀释浓H2SO4
E.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①98%的浓硫酸的物质的量浓度为_____________mol·L-1
②配制成浓度为0.5mol·L-1的稀硫酸500毫升.所需98%的浓硫酸的体积为____________mL;(保留小数点后一位)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是_____;
④定容时必须使溶液凹液面与刻度线相切,若仰视刻度则使浓度___________。(“偏高”、“偏低”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为________;Z的核外电子排布式是________;
(2)D的最高价氧化物与E的一种氧化物为等电子体,写出E的氧化物的化学式________;
(3)D和Y形成的化合物,其分子的空间构型为________;D原子的轨道杂化方式是________;
(4)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大
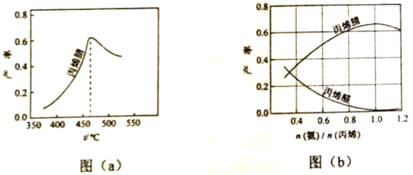
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为1理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com