
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是________(写化学式)。
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) △H=_________kJ/mol。
O2(g) △H=_________kJ/mol。
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。
① 工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为
CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO。下图是变压吸附回收高炉煤气中CO的流程图:
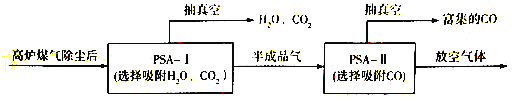
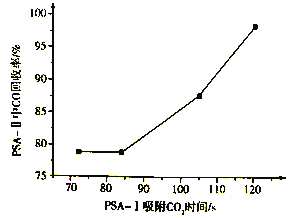
PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是________, “放空气体”的主要成分为_______。
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+ 3 CO(g)===2Fe (s)+3CO2(g)。该反应在不同温度下的平衡常数如下表所示:
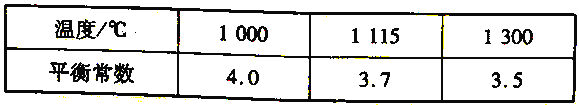
① 该反应的△H______0(填“> " " < ”或“= " )。
② 欲提高上述反应中CO 的转化率,可采取的措施是______。
a.适当降低反应体系的温度 b.及时移出体系中的CO2 c.加入合适的催化剂
d.减小容器的容积 e.增大Fe2O3的量
【答案】 N2、CO +35.7 ①升温、减压 延长PSA -I吸附CO2时间 N2 < ab
【解析】试题分析:(1)N2、CO、CO2、H2O的电子数分别是14、14、22、10;(2)根据盖斯定律计算CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) 的△H;(3)①根据平衡移动原理分析;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO;(4)①升高温度,平衡常数减小,平衡逆向移动;②平衡正向移动,可以提高CO 的转化率;
O2(g) 的△H;(3)①根据平衡移动原理分析;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO;(4)①升高温度,平衡常数减小,平衡逆向移动;②平衡正向移动,可以提高CO 的转化率;
解析:(1)N2、CO、CO2、H2O中N2、CO的电子数相等;
(2)① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
根据盖斯定律,①![]() ②
② ![]() ③ 得CO(g)+2H2(g)=CH4(g)+
③ 得CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) △H=+35.7 kJ/mol;(3)①CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0,要分离CO可使平衡逆向移动,如升温、减压等;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大,所以应采取的措施是延长PSA -I吸附CO2时间;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO,所以“放空气体”的主要成分为N2;(4)①升高温度,平衡常数减小,平衡逆向移动,所以正反应放热,△H<0;②a.适当降低反应体系的温度,平衡正向移动,CO 的转化率增大; b.及时移出体系中的CO2,平衡正向移动,CO 的转化率增大; c.加入合适的催化剂,平衡不移动,CO 的转化率不变,故c错误;d.减小容器的容积,平衡不移动,CO 的转化率不变,故d错误; e.Fe2O3是固体,增大Fe2O3的量,平衡不移动,CO 的转化率不变,故e错误。
O2(g) △H=+35.7 kJ/mol;(3)①CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0,要分离CO可使平衡逆向移动,如升温、减压等;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大,所以应采取的措施是延长PSA -I吸附CO2时间;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO,所以“放空气体”的主要成分为N2;(4)①升高温度,平衡常数减小,平衡逆向移动,所以正反应放热,△H<0;②a.适当降低反应体系的温度,平衡正向移动,CO 的转化率增大; b.及时移出体系中的CO2,平衡正向移动,CO 的转化率增大; c.加入合适的催化剂,平衡不移动,CO 的转化率不变,故c错误;d.减小容器的容积,平衡不移动,CO 的转化率不变,故d错误; e.Fe2O3是固体,增大Fe2O3的量,平衡不移动,CO 的转化率不变,故e错误。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】1799年,意大利物理学家伏特把一块锌板和一块锡板浸在盐水里,发现连接两块金属板的导线中有电流通过。下列说法正确的是( )
A.锌板是正极
B.锡板被氧化
C.盐水是电解质溶液
D.电子由锡板沿导线流向锌板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂和糖类共性的叙述中不正确的是 ( )
A. 都是人类生命活动的物质基础
B. 一定都是混合物
C. 组成元素一般都是C、H、O
D. 前者全部是小分子,后者部分是大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
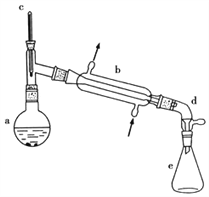
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量![]()
Ⅰ![]() 实验步骤
实验步骤
(1)配制100mL待测白醋溶液:用 ______ ![]() 填仪器名称
填仪器名称![]() 量取
量取![]() 市售白醋,在烧杯中用水稀释后转移到 ______
市售白醋,在烧杯中用水稀释后转移到 ______ ![]() 填仪器名称
填仪器名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
(3)读取盛装![]() NaOH溶液的碱式滴定管的初始读数
NaOH溶液的碱式滴定管的初始读数![]() 如果液面位置如图所
如果液面位置如图所![]() 示,则此时的读数为 ______ mL.
示,则此时的读数为 ______ mL.
(4)滴定![]() 当 ______ 时,停止滴定,并记录NaOH溶液的终读数
当 ______ 时,停止滴定,并记录NaOH溶液的终读数![]() 重复滴定3次.
重复滴定3次.
(5)实验记录
滴定次数实验数据 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
Ⅲ![]() 数据处理与讨论
数据处理与讨论
按实验所得数据,可得![]() 市售白醋
市售白醋![]() ______
______ ![]() ;市售白醋总酸量
;市售白醋总酸量![]() ______
______ ![]() .
.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是 ______ (填写序号![]() .
.
![]() 碱式滴定管在滴定时未用标准NaOH溶液润洗
碱式滴定管在滴定时未用标准NaOH溶液润洗
![]() 碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
![]() 锥形瓶中加入待测白醋溶液后,再加少量水
锥形瓶中加入待测白醋溶液后,再加少量水
![]() 锥形瓶在滴定时剧烈摇动,有少量液体溅出.
锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在在生活生产中有着重要应用.
(1)粗制![]() 晶体中常含有杂质
晶体中常含有杂质![]() .
.
①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是 ______ .
,下列物质最好选用的是 ______ .
A. ![]()
![]()
![]() 氯水
氯水![]()
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的 ______ .
,调整溶液pH可选用下列中的 ______ .
A.NaOH ![]()
![]()
![]()
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,先生成 ______ 沉淀
混合溶液中逐滴加入氨水,先生成 ______ 沉淀![]() 填化学式
填化学式![]() ,生成该沉淀的离子方程式为 ______
,生成该沉淀的离子方程式为 ______ ![]() 已知
已知![]() 时
时![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]() ______
______ ![]()
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是 ______ ,产生该现象的原因是
可以观察到的现象是 ______ ,产生该现象的原因是![]() 用离子方程式表示
用离子方程式表示![]() ______ 已知:Ksp[
______ 已知:Ksp[![]() ]=4.0x10-38。
]=4.0x10-38。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的图像的说法不正确是 ( )
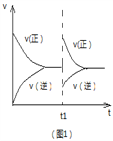
A. 图1可表示反应2NO2![]() N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
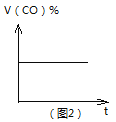
B. 图2可表示CO(g)+2H2(g)![]() CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
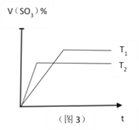
C. 图3可表示反应2SO2 +O2![]() 2SO3 ,温度T1>T2,反应为吸热反应。
2SO3 ,温度T1>T2,反应为吸热反应。
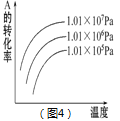
D. 图4可表示反应mA(g)+nB(g)![]() pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com