
【题目】外围电子构型为3d104s1的元素的原子在周期表中应位于
A. 第五周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第四周期ⅠB族
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备
过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

步骤①加入氨水的目的是________________。小火煮沸的作用是使沉淀颗粒长大,有利于__________________。
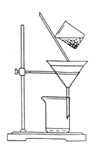
(2)如图是某学生的过滤操作示意图,其操作不规范的是_________(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
![]()
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈_______性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是______________。
(4)步骤③中反应的化学方程式为____________________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是___________。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______________,产品的缺点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 50ml,12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
B. 常温常压下4.4g乙醛所含σ键数目为0.7NA
C. 向浓H2SO4中通入H2S气体,1mol浓H2SO4转移电子数一定是2 NA
D. 2.0gH218O与D2O的混合物中所含中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的元素中,一定属于主族元素的有
A. 元素的原子最外层电子个数为2
B. 元素的原子最外层电子个数为6
C. 位于元素周期表中ⅡA族右边的元素
D. 阴离子RO4﹣中R元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的工业原料,其结构简式如图:
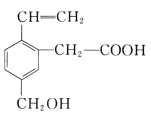
试回答下列问题:
(1)有机物A的分子式为 ;
(2)有机物A中含有的含氧官能团名称是 ;
(3)0.5 mol 该物质与足量金属钠反应,能生成标准状况下的氢气 L;
(4)该物质能发生的反应有 (填序号)。
①能与NaOH溶液反应
②能与溴的四氯化碳溶液反应
③能与甲醇发生酯化反应
④可以燃烧
⑤能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能最的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能最和反应物具有的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com