
����Ŀ��������������ˮ�������ᣬ���������Լ���ҽ�÷���������������������һ���Ʊ�
�������Ƶ�ʵ�鷽�����ش��������⣺
��һ��̼��Ƶ��Ʊ�

���������백ˮ��Ŀ����________________��С����е�������ʹ������������������__________________��
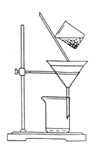
(2)��ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����_________�����ţ���
a��©��ĩ�˾���δ�����ձ���
b����������������
c������ֽʪ��ʹ�����©����
d����ֽ��Ե�߳�©��
e���ò�������©������������Լӿ�����ٶ�
(��)�������Ƶ��Ʊ�
![]()
(3)�������ľ������Ϊ��μ���ϡ���ᣬ����Һ���д����������壬��ʱ��Һ��_______�ԣ���������������������������������Һ��У����ȹ��ˡ�����Һ��е�������______________��
(4)�������з�Ӧ�Ļ�ѧ����ʽΪ____________________��
(5)�����˵õ��İ�ɫ�ᾧ����ʹ������ˮ���Ҵ�ϴ�ӣ�ʹ���Ҵ�ϴ�ӵ�Ŀ����___________��
(6)�Ʊ��������Ƶ���һ�ַ����ǣ���ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ���ù��շ������ŵ���______________����Ʒ��ȱ����_______________��
���𰸡�(1)������ҺpHʹFe(OH)3���������˷���
(2)ade (3)������ȥ��Һ���ܽ��CO2
(4)CaCl2��2NH3��H2O��H2O2=CaO2����2NH4Cl��2H2O��
CaCl2��2NH3��H2O��H2O2��6H2O=CaO2��8H2O����2NH4Cl
(5)ȥ���ᾧ����ˮ��(6)���ռ��������㣻���Ƚϵ�
��������
�����������1��ʯ��ʯ�к��������������˫��ˮ��Ŀ���ǽ�������������Ϊ�����ӣ��ټӰ�ˮ������pHʹ������ת��Ϊ����������ȥ��С����е�������ʹ�����������������ڽ������Ĺ��˲�������Ϊ��������ҺpHʹFe(OH)3��������Ϊ��������ҺpHʹFe(OH)3���������˷�������2�����˲����в��淶���ǣ�a��©��ĩ�˾���δ�����ձ��ڣ������Һ��ɽ���d����ֽ��Ե�߳�©����������ֽŪ�ƣ�e���ò�������©������������Լӿ�����ٶȣ�������ֽ���ƣ���Ϊ��ade����3���������ľ������Ϊ��μ���ϡ���ᣬ����Һ���д����������壬��Һ�е��������Ȼ��ƺ��ܽ������������̼����ʱ��Һ�����ԣ���е�Ŀ����Ϊ�˳�ȥʣ���û�лӷ����CO2����Ϊ��������ȥ��Һ���ܽ��CO2����4���������з�Ӧ�Ļ�ѧ����ʽΪCaCl2 �� 2NH3��H2O �� H2O2 = CaO2�� �� 2NH4Cl �� 2H2O��CaCl2 �� 2NH3��H2O �� H2O2 �� 6H2O = CaO2��8H2O�� �� 2NH4Cl����Ϊ��CaCl2 �� 2NH3��H2O �� H2O2 = CaO2�� �� 2NH4Cl �� 2H2O��CaCl2 �� 2NH3��H2O �� H2O2 �� 6H2O = CaO2��8H2O�� �� 2NH4Cl����5�����Ҵ�ϴ����Ҫ�������Ҵ����лӷ��ԣ��������Ҵ���ȥ��������ˮ�֣���Ϊ��ȥ���ᾧ����ˮ�֣���6����ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ��ù�����������ŵ��ǹ��ռ��������㣬���������Ʊ��Ĺ��������е����ʺܶ࣬���Ƚϵͣ���Ϊ�����ռ��������㣻���Ƚϵ͡�


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����̼ԭ��һ����һ��ƽ���ڵ��ǣ��� ��
A��2-��ϩ B������ C������ϩ D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5molij�����������Ҵ�����������Ӧ����������������ԭ���������������28g����ԭ���������
A. ���� B. �Ҷ��� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л������NaCl ��NaOH ��HCl ��NH4Cl ��CH3COONa ��CH3COOH ��NH3H2O ��H2O���ش��������⣮
��1��NH4Cl��Һ�����ԣ������ӷ���ʽ��ʾԭ�� ������Һ������Ũ�ȴ�С˳��Ϊ ��
��2�������£�pH=11��CH3COONa��Һ�У�ˮ���������c��OH����= ����pH=3��CH3COOH��Һ�У�ˮ���������c��H+��= ��
��3��������pH��������Ģ�NaOH�͢�NH3H2O�ֱ��ˮϡ��m����n����ϡ�ͺ�������Һ��pH����ȣ���m n�������������������=����
��4����ǰ������Һ�����ʵ���Ũ����ͬ��������ų���������ҺpH�ɴ�С��˳�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼������ɫ������������Ŀ�����ԣ������������Ա�����֡������ֻ�������ǵȡ�˫�ӻ������Ǻϳɾ�̼�����ĵ���֮һ��ij��˫�ӻ�����G�ĺϳ�·�����£�
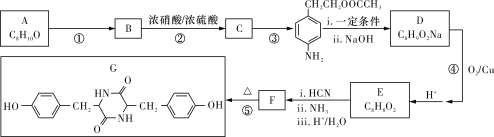
��֪��![]()
NO2![]() NH2
NH2
(1)G�������Ĺ����ŵ���������������____________��B�ĺ˴Ź���������________���塣
(2)д����Ӧ���ͣ���Ӧ�� __________����Ӧ��____________��
(3)д��A������ ______________��F�Ľṹ��ʽ_____________________��
(4)д����Ӧ���Ļ�ѧ����ʽ��_________________________��
(5)C�ж���ͬ���칹�壬д��ͬʱ��������������ͬ���칹��Ľṹ��ʽ________________________��
(��)�������������ᣬ�ұ�������������Ϊ��λ��ȡ����
(��)��FeCl3��Һ��������ɫ����
(��)1 mol��ͬ���칹��������NaOH��Һ��Ӧʱ����3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X����ͨ��BaCl2��Һ��δ���������ɣ�Ȼ��ͨ��Y���壬�г������ɣ�X��Y�����ܵ���
ѡ�� | A�� | B�� | C�� | D�� |
X | SO2 | CO2 | CO2 | SO2 |
Y | Cl2 | Cl2 | NH3 | H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��ǿ������Һ�У������������ܴ�����������ҺΪ��ɫ�����ǣ� ��
A��Na+��K+ ��OH����Cl�� B��Na+��Cu2+��SO42����NO3��
C��K+��Mg2+��SO42����Cl�� D��Ba2+��HCO3����NO3����K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��4 ��5 ��6���ڵĸ���Ԫ�ؾ�Ϊ10��
B. �����͵������ڵ���ͬ����Ԫ�ص�ԭ������һ�����18
C. 117��Ԫ�ؿ����ǽ���Ԫ��
D. Ԫ�����ڱ��е������ڵ�VA���Ԫ�������������AԪ�غ˵�������13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Χ���ӹ���Ϊ3d104s1��Ԫ�ص�ԭ�������ڱ���Ӧλ��
A. ����������B�� B. ����������B��
C. ����������B�� D. ����������B��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com