
【题目】 在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+ 、OH—、Cl— B.Na+、Cu2+、SO42—、NO3—
C.K+、Mg2+、SO42—、Cl— D.Ba2+、HCO3—、NO3—、K+
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途。已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
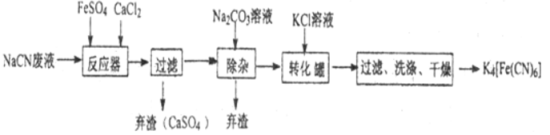
(1)常温下,NaCN水溶液的pH 7(填“>”、“<”、“ = ”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于 溶液,再用蒸馏水稀释。
(2)反应器中发生的主要反应的化学方程式为 。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、 。
(4)转化器中生成K4[Fe(CN)6]的反应类型是 ,相同温度下,溶解度:K4[Fe(CN)6] Na4[Fe(CN)6](填“>”“ = ”“<”),过滤后洗涤K4[Fe(CN)6]使用的试剂是 。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 。
(6)含有14.7kgNaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是( )
A.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备
过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

步骤①加入氨水的目的是________________。小火煮沸的作用是使沉淀颗粒长大,有利于__________________。
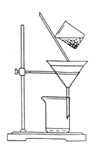
(2)如图是某学生的过滤操作示意图,其操作不规范的是_________(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
![]()
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈_______性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是______________。
(4)步骤③中反应的化学方程式为____________________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是___________。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______________,产品的缺点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是
选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
B | NH3·H2O | 小苏打 | 氧化镁 | 二氧化氮 |
C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述中正确的是( )
A.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似
B.石油裂化的主要目的是为了提高轻质液体燃料的产量
C.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
D.煎炸食物的花生油和牛油都是可皂化的饱和酯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 50ml,12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
B. 常温常压下4.4g乙醛所含σ键数目为0.7NA
C. 向浓H2SO4中通入H2S气体,1mol浓H2SO4转移电子数一定是2 NA
D. 2.0gH218O与D2O的混合物中所含中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com