
【题目】镁-空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。下列说法错误的是
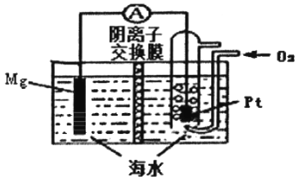
A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-=Mg2+
D. 采用多孔Pt电极有利于氧气扩散,提高电极与电解质溶液的接触而积
【答案】C
【解析】分析:负极上Mg失电子生成Mg2+,而正极上氧气发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,由此分析解答。
详解:A、氧气在正极发生得到电子的还原反应,所以通入氧气的电极为正极,A正确;
B、原电池中阴离子向负极移动,所以放电时,溶液中的OH-由正极移向负极,B正确;
C、负极镁失电子变成镁离子,正极移过来的氢氧根离子结合生成氢氧化镁,所以电极反应式为:Mg-2e-+2OH-=Mg(OH)2,C错误;
D、反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,D正确;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是( )
A.漂白粉被氧化了
B.漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C.有色布条被空气中的氧气氧化
D.漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是________,键长较长的是________。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)SO2与CO2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是____________________________。
(4)醋酸的球棍模型如图1所示。
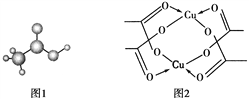
①在醋酸中,碳原子的轨道杂化类型有________;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。
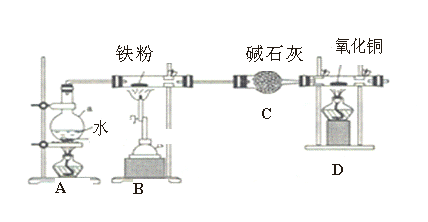
(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
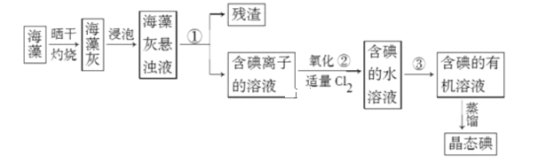
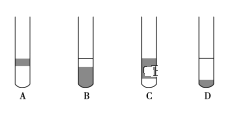
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(3)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(4)应称取的 NaOH 固体的质量为________ g。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A.使用滤纸称量 NaOH 固体 B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤 D.用胶头滴管加水定容时俯视刻度
E.加水时超过刻度线,用胶头滴管吸出 F.转移溶液之前未经冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 0.1mol·L1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
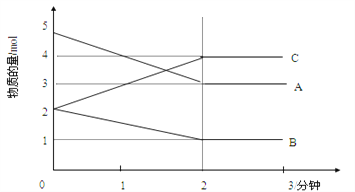
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度B.加入催化剂(正)C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
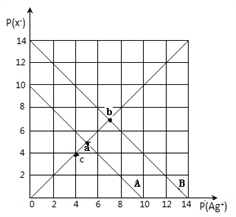
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com