
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。
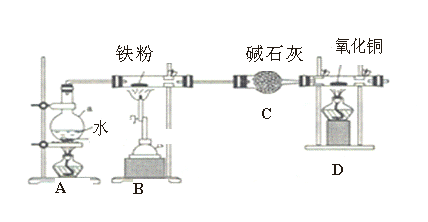
(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
【答案】产生水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 2NA 有黑色变为红色, 硬质玻璃管右端管壁内有水珠 CuO + H2
Fe3O4+4H2 2NA 有黑色变为红色, 硬质玻璃管右端管壁内有水珠 CuO + H2![]() Cu + H2O 先点A处,再点燃B处
Cu + H2O 先点A处,再点燃B处
【解析】
由图可知,A中加热提供水蒸气,在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,C中干燥管干燥氢气,产生氢气还原氧化铜,B中增重的质量其实就是氧的质量。
(1)装置B中铁粉在高温下与水蒸气反应,则A的作用为提供水蒸气,答案为:产生水蒸气;
(2)在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,反应的方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,H原子的化合价由+1变为0价,得电子,标准状况下的22.4L为1mol,则转移2mol电子,即2NA;答案为:3Fe+4H2O(g)
Fe3O4+4H2,H原子的化合价由+1变为0价,得电子,标准状况下的22.4L为1mol,则转移2mol电子,即2NA;答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;2NA;
Fe3O4+4H2;2NA;
(3)D中是氢气还原氧化铜得到铜和水即CuO + H2![]() Cu + H2O,观察到的现象为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;CuO + H2
Cu + H2O,观察到的现象为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;CuO + H2![]() Cu + H2O;
Cu + H2O;
(4)氢气还原氧化铜时,先通入氢气排净装置中的空气,以防爆炸,停止反应时,先停止加热氧化铜,再停止通氢气,答案为:先点A处,再点燃B处;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。

(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
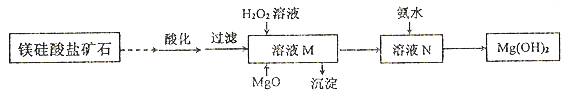
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
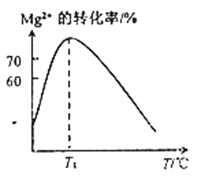
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离()。
A. 甲苯与水 B. 乙醇与水 C. 碘与水 D. 硝酸钾与氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
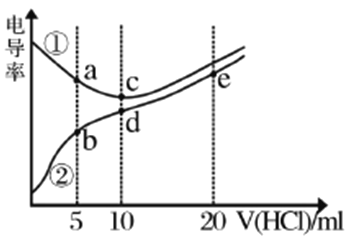
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点高于d点
C. b点溶液中:c[(CH3)2NH2+]+c[(CH3)2NH·H2O]=2c(Cl-)
D. d点溶液中:c(H+)+ c[(CH3)2NH·H2O]=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是__________。
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________。
(3)B3分子的空间构型为______,其中B原子的杂化类型是______,与B3分子互为等电子体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。 写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。
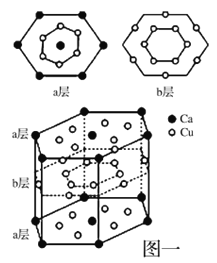
己知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。下列说法错误的是
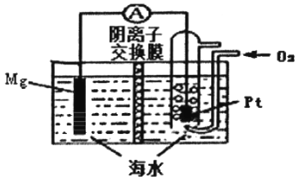
A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-=Mg2+
D. 采用多孔Pt电极有利于氧气扩散,提高电极与电解质溶液的接触而积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)是VIA族非金属元素,其单质和化合物在太阻能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____(填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)己知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______(α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一和工芝流程如下:
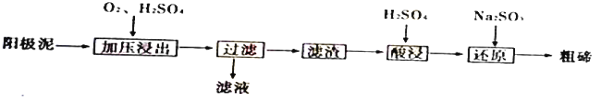
③己知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是_____________。
④防止局部酸度过大的操作方法是___________。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________。
⑥“还原”得到固态碲后分离出粗碲的方法是________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理的发展在化学的发展史上有重要的推动作用。
(1)下图为N2和O2生成NO时的能量变化情况。

则NO分解为N2和O2的反应是 (填“吸热”或“放热”)反应。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,一定条件下发生反应:
NO2(g)+ CO(g) ![]() CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
①该段时间内,用CO2表示的平均反应率为 。
②下列事实能说明此反应在该条件下已经达到化学平衡的是 (填序号)。
A.容器内气体总质量保持不变 B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等 D.容器内气体总物质的量保持不变
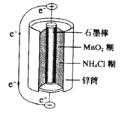
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示。电路中每通过0.4mol电子,负极质量减少 g;工作时NH4+在正极放电产生两种气体,其中一种气体分子是含10电子的微粒,正极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C3H8的燃烧热(△H)为-2219.9kJ/mol,且C3H8和H2O的汽化热分别为18.8KJ/mol、44.0kJ/mol。(汽化热是指在一定温度下,1mol物质由液态变成气态的过程中所吸收的热量。)
(1)试计算8.8g以液化石油气存在的C3H8在氧气中完全燃烧生成水蒸气时放出的热量为____________。
(2)在体积可变的密闭容器中投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
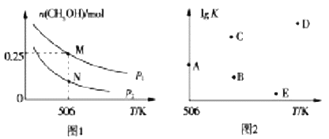
①M点时,H2的转化率为_________;压强:p1________p2(填“>”“<”或“=’’)
②反应速率:N点v正(CO)_________M点v逆(CO) (填“>”“<”或“=’’)
③若压强为p1、在1L恒容密闭容器中进行上述反应(应始投料不变,在不同温度下上述反应的平衡常数的对数(lgK)如图2所示。则温度为506K时,平衡常数K=________(保留三位小数),B、C、D、E四点中能正确表示该反应的lgK与T的关系的点为________。
④某温度下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)![]() CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
(3)以二甲醚(CH3OCH3)为燃料、氧气为氧化剂、KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性材料)。
①若KOH溶液足量,则负极的电极反应式为____________。
②若电解质溶液中KOH的物质的量为0.2mol,当有0.1mol二甲醚参加反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com