
����Ŀ����֪A�������������������Ľ�����BΪ����ɫ��ĩ���ڳ�����CΪ��ɫҺ�壬E��G��H��I��JΪ���壬����HΪ����ɫ������Ϊ��ɫ��J��ʹʪ��ĺ�ɫʯ����ֽ������ͼ�в��ֲ�������ȥ����
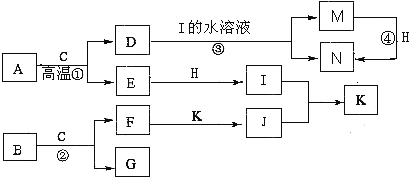
����д���пհ�
��1��д����ѧʽ��D ��K ��
��2��д���������ӷ���ʽ ��
��3����Ӧ�����������к��ַ�Ӧ���� ������ĸ��ţ���
A�����Ϸ�Ӧ B��������ԭ��Ӧ C�����ӷ�Ӧ D���û���Ӧ
��4����Ҫȷ������Ӧ��������Һ�к���M���ʣ���ѡ�Լ�Ϊ ������ţ���
A��KSCN��Һ����ˮ B�����ۺ�KSCN
C��Ũ��ˮ D�����Ը��������Һ
��5����F���뵽M����Һ�ﲢ¶���ڿ����У����Թ۲쵽�������̵������ǣ�
��
��6�������£�H�������J��Ӧ����Ũ��İ��̣���һ�������ǿ�������Ҫ�ɷ�֮һ����д���÷�Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1��Fe3O4��NH4Cl��2�֣���1�֣�
��2��2Na2O2��2H2O ��4Na+��4OH����O2����2�֣�
��3��D��1�֣���4��D��3�֣�
��5��������ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��2�֣�
��6��8NH3��3Cl2��N2��6NH4Cl��2�֣�
�������������������1�������ͻ�ƿ�Ϊ��Ŀ�������ʵ���ɫ��״̬��������Щ��Ϣ���Ƴ��������ʣ�Ȼ����ݿ�ͼ�Ƴ��������ʡ�A�������������������Ľ�����ΪFe���ڳ�����CΪ��ɫҺ�壬��CΪH2O��BΪ����ɫ��ĩ������H2O��Ӧ����BΪNa2O2��HΪ����ɫ��HΪCl2��J��ʹʪ��ĺ�ɫʯ����ֽ��������JΪNH3�������ͼ�ɵ��������ʣ�DΪFe3O4��EΪH2��FΪNaOH��GΪO2��IΪHCl��KΪNH4Cl��MΪFeCl2��NΪFeCl3��
��2����ΪNa2O2��H2O��Ӧ����NaOH��O2�������ó����ӷ���ʽ��
��3����Ӧ��Ϊ��Cl2+2FeCl2=2FeCl3���÷�Ӧ���ڻ��Ϸ�Ӧ��������ԭ��Ӧ�����ӷ�Ӧ�����������û���Ӧ��
��4����Ӧ��ΪFe3O4��HCl��Ӧ����FeCl2��FeCl3��Ҫ����FeCl2������FeCl2�Ļ�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ���м��顣
��5����NaOH���뵽FeCl2��Һ�У���������Fe(OH)2��Ȼ��Fe(OH)2��O2��H2O��Ӧ����Fe(OH)3���ʷ�Ӧ����Ϊ��������ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��6��Cl2�������NH3��Ӧ��������Ũ��İ���ΪNH4Cl����һ�������ǿ�������Ҫ�ɷ֣�ΪN2����ƽ�ɵû�ѧ����ʽ��8NH3��3Cl2��N2��6NH4Cl��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������IJ�����ߣ��ϵ�ر�����м��д��������ⱻ�ᵽ�����ճ̣�����Ҫԭ���ǣ�������
A.���õ����ǵĽ�������
B.��ֹ����й����Ӻ�Ǧ���ؽ������Ӷ�������ˮԴ�����Ⱦ
C.��ʹ��������ĵ��Һ��ʴ������Ʒ
D.��������ʯī�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ��![]() ��ʽ���ڡ���ѧ����С�齫�������ճɻң���ˮ����һ��ʱ�䣬�õ�����������Һ��Ȼ������ʵ��������ȡ
��ʽ���ڡ���ѧ����С�齫�������ճɻң���ˮ����һ��ʱ�䣬�õ�����������Һ��Ȼ������ʵ��������ȡ![]() ���ʣ���֪
���ʣ���֪![]() ��������
��������![]() ����
����
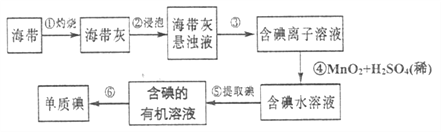
��1��ָ����ȡ��Ĺ������йص�ʵ��������ƣ���_________��__________��
��2����ȡ��Ĺ����У��ɹ�ѡ����л��ܼ���__________������ĸ���ţ���
A. �ƾ� B. ![]() C. ����
C. ����
��3���������ÿ����![]() ת��
ת��![]() ���ӣ�����
���ӣ�����![]() ��������Ӧ�����ӷ���ʽΪ___________��
��������Ӧ�����ӷ���ʽΪ___________��
��4��Ϊʵ�ֲ���ݵ�ת����ʵ���������ձ����������������Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ���������___________��
��5�����ͨ������ݲ������ɻ�ȡ�ϸ�Ũ�ȵĺ����л���Һ������������ȡ![]() �����Լ���
�����Լ���![]() ��
��![]() ��Һ����
��Һ����![]() ת���ɿ�����ˮ�ĺ��⻯���
ת���ɿ�����ˮ�ĺ��⻯��� ![]() ��������I����õ����⻯�����ˮ��Һ���������м��������45����������Һ������
��������I����õ����⻯�����ˮ��Һ���������м��������45����������Һ������![]() ������������II��õⵥ�ʡ������I��������_________������II��������________������ĸ����
������������II��õⵥ�ʡ������I��������_________������II��������________������ĸ����
A. ���� B. ���� C. ���� D. ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ���л��������м��壮ʵ�����ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·�����£�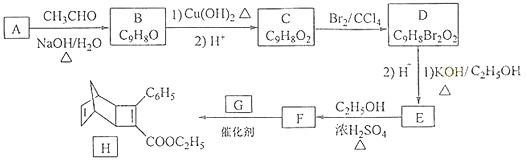
��֪����RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
�� ![]() +
+ ![]()
![]()
![]()
�ش��������⣺
��1��A�Ļ�ѧ����ΪΪ ��
��2����C����D��E����F�ķ�Ӧ���ͷֱ�Ϊ�� ��
��3��E�Ľṹ��ʽΪ ��
��4��GΪ�ױ���ͬ���칹�壬��F����H�Ļ�ѧ����ʽΪ ��
��5�����㻯����X��F��ͬ���칹�壬X���뱥��̼��������Һ��Ӧ�ų�CO2 �� ��˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6:2:1:1��д��2�ַ���Ҫ���X�Ľṹ��ʽ ��
��6��д���û������2����ȲΪԭ���Ʊ������� 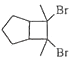 �ĺϳ�·���������Լ���ѡ����
�ĺϳ�·���������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���.
��1����25�������½�pH=11�İ�ˮϡ��100������Һ��pHΪ������ţ� ��
A.9
B.13
C.11��13֮��
D.9��11֮��
��2��25��ʱ����0.1mol/L�İ�ˮ�м��������Ȼ�粒��壬�������ܽ�����ҺpH��С����Ҫԭ���ǣ�����ţ� ��
A.��ˮ���Ȼ�立�����ѧ��Ӧ
B.�Ȼ����Һˮ�������ԣ�������c��H+��
C.�Ȼ������ˮ���������������ӣ������˰�ˮ�ĵ��룬ʹc��OH������С
��3�������£������0.1mol NH4Cl��0.05mol NaOHȫ������ˮ���γɻ����Һ����������ʧ����
�����������ӵ����ʵ���֮�͵���0.1mol��
�����������ӵ����ʵ���֮�ͱ�OH����0.05mol��
��4����֪ij��Һ��ֻ����OH����H+��NH4+��Cl���������ӣ�ijͬѧ�Ʋ����Һ�и�����Ũ�ȴ�С˳��������������ֹ�ϵ��
A��c��Cl������c��NH4+����c��H+����c��OH����
B��c��Cl������c��NH4+����c��OH������c��H+��
C��c��Cl������c��H+����c��NH4+����c��OH����
D��c��NH4+����c��Cl������c��OH������c��H+��
������Һ��ֻ�ܽ���һ�����ʣ������ʵ������� �� ��������Ũ�ȴ�С˳���ϵ����ȷ���ǣ�ѡ����ţ� ��
����������ϵ��C����ȷ�ģ�����Һ�����ʵĻ�ѧʽ�� ��
��������Һ���������ȵ�ϡ����Ͱ�ˮ��϶��ɣ���ǡ�ó����ԣ�����ǰc��HCl��c��NH3H2O���������������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8��5���ڰ�����Լ�ٿ��ĵ�31����˻ᣬ�����˷ܼ��¼���ʹ��������˹�˶�Ա���������ֹ�˶�Աʹ���˷ܼ��ǰ��˻ṫƽ����������Ҫ�ٴ�֮һ�������������˷ܼ��Ľṹ�ֱ�Ϊ�� 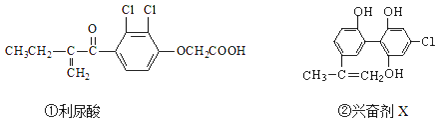
��������������˷ܼ���˵���в���ȷ���ǣ�������
A.�������ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
B.1mol�˷ܼ�X������Ũ��ˮ��Ӧ���������3molBr2
C.����FeCl3��Һ������������Ƿ����˷ܼ�X
D.1mol�˷ܼ�X���ܺ�5molNaOH����Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ�Ϊͬ����������ǣ�������
A.126C��146C
B.�����ͳ���
C.���������
D.��������춡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ���л�����Ŀ�������ʽΪClC4H7O2������̼�����Ʒ�Ӧ����������л�����Ŀ��ͬ���ǣ����������칹���� ��
A.����ʽΪC5H10 ��ϩ��
B.����ʽΪC4H8O2 ����
C.�ױ��� ![]() ����һ�ȴ���
����һ�ȴ���
D.�����飨 ![]() ���Ķ��ȴ���
���Ķ��ȴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���ͬ�������������壬ռ������ɴ�С��˳���Ǣ� Cl2�� H2�� N2�� CO2�� O2
A.�ۢڢܢݢ�B.�ݢڢܢۢ�
C.�٢ܢݢڢ�D.�ڢۢݢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com