
| A、生成乙烯的是热的氢氧化钾的水溶液 |
| B、生成乙醇的是热的氢氧化钾的水溶液 |
| C、生成乙烯的是在170℃下进行的 |
| D、生成乙醇的是热的氢氧化钾的醇溶液 |
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液中:Na+、ClO-、S2-、NH4+ |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
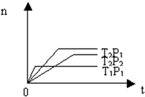 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+,Al3+,Ag+,Ba2+,Fe3+ |
| 阴离子 | Cl-,CO32-,SO42-,NO3-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃仪器外壁有水可以直接用酒精灯加热 |
| B、把鼻孔凑近瓶口闻药品的气味 |
| C、酒精灯用完后,可用嘴吹灭 |
| D、实验用剩的药品一般不能随意丢弃,也不放回原瓶,但实验剩余的金属钠必须放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 400℃ | 500℃ | 800℃ | 1000℃ |
| 平衡常数 | 10 | 9 | 1 | 0.5 |
| 4 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
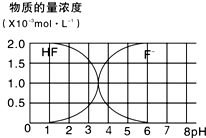 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池的正极为锌 |
| B、电池正极反应式为:2MnO2+2e-+2H2O═2MnO (OH)+2OH- |
| C、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D、该电池反应中二氧化锰起催化剂作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com