
【题目】将一定量氨基甲酸铵加入恒容容器中:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
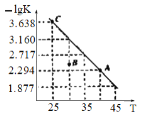
A. 该反应的生成物总能量大于反应物总能量
B. 处于A点的CO2的消耗速率大于处于C点的CO2消耗速率
C. B点时,v逆>v正
D. CO2的体积分数不变时反应一定达到平衡状态
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药 I 的合成路线如下:

已知:a. 
b.  RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是_____;F 的化学名称为_____。
(2)②的反应类型是_____;A→B 的化学方程式为_____。
(3)G 的结构简式为_____;H 中所含官能团的名称是_____。
(4)化合物 W 的相对分子质量比化合物 C 大 14,且满足下列条件,W 的可能结构有_____种,其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2∶2∶2∶1∶1 的结构简式为_____。
①遇 FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线_____(无机试剂任选)。
的合成路线_____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Br2、I2能否将Fe2+氧化,实验如下。
实验 | 试剂x | 现象及操作 |
| 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(1)实验ⅰ中产生Fe3+ 的离子方程式是________。
(2)以上实验体现出氧化性关系:Br2_______I2(填“>”或“<”)。
(3)针对实验ⅱ中未检测到Fe3+,小组同学I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验ⅲ:向ⅱ的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,_________(填操作和现象),证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
(5)针对上述现象,小组同学提出不同观点并对之进行研究。
① 观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:______。经证实观点1合理。
② 观点2:Fe3+ 可能由Ag+ 氧化产生。
实验ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填现象、操作),观点2合理。
(6)观点1、2虽然合理,但加入AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。设计实验:取ⅱ的黄色溶液,______(填操作、现象)。由此得出结论:不能充分说明(4)中产生Fe3+的原因是由反应a的平衡移动造成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,W的单质是黄绿色气体,X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式_____________。
(2)成外高一化学兴趣小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)__________;若装置D中装的是铁粉,当通入W2时观察到的现象为______________;若装置D中装的是催化剂,当通入YX2时,打开K通入适量X2,化学反应方程式为___________________;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)________________,可以看到白色沉淀生成,其原因分别为________________________________________________________________________。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)若由元素Y和X组成 酸根Z(Y2X32-),当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,该反应的离子方程式为_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
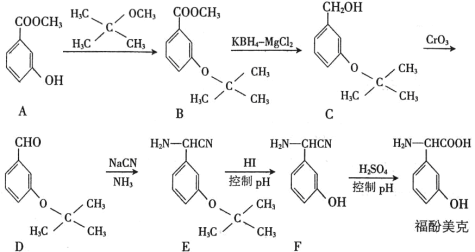
按要求回答下列问题:
(1)物质A的名称是_________________。
(2)B→C的转化属于_____________(填反应类型)反应。
(3)上述流程中设计A→B步骤的目的是________________________________________。
(4)A与足量氢氧化钠溶液反应的化学方程式为____________________________________。
(5)A的芳香类同分异构体X满足下列条件:
I.能与NaHCO3反应放出气体; II.能与FeCl3溶液发生显色反应。
符合上述条件的同分异构体有_______种,其中核磁共振氢谱有5组吸收峰的结构简式为_______。
(6)参照上述合成路线和信息,以乙醛为原料(无机试剂任选),设计制备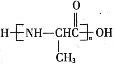 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K=1.75×10-5
次氯酸K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式:K1=________。
(2)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________(填字母,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(3)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===![]() +HClO
+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-===![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则25℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________.
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________.
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的Na 和Al一同投入mg足量水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为( )
A. 1000aρ/(46a+m)mol·L-1 B. 4ρ/(46a+m)mol·L-1
C. 1000aρ/(50a+m)mol·L-1 D. 1000aρ/(45a+m)mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com