
ЁОЬтФПЁПИпбЊжЌЪЧвЛжжГЃМћЕФаФбЊЙмМВВЁЃЌжЮСЦИпбЊжЌЕФаТвЉ I ЕФКЯГЩТЗЯпШчЯТЃК

вбжЊЃКa. 
b.  RCHO
RCHO
ЛиД№ЯТСаЮЪЬтЃК
(1)ЗДгІЂйЫљашЪдМСЁЂЬѕМўЗжБ№ЪЧ_____ЃЛF ЕФЛЏбЇУћГЦЮЊ_____ЁЃ
(2)ЂкЕФЗДгІРраЭЪЧ_____ЃЛAЁњB ЕФЛЏбЇЗНГЬЪНЮЊ_____ЁЃ
(3)G ЕФНсЙЙМђЪНЮЊ_____ЃЛH жаЫљКЌЙйФмЭХЕФУћГЦЪЧ_____ЁЃ
(4)ЛЏКЯЮя W ЕФЯрЖдЗжзгжЪСПБШЛЏКЯЮя C Дѓ 14ЃЌЧвТњзуЯТСаЬѕМўЃЌW ЕФПЩФмНсЙЙга_____жжЃЌЦфжаКЫДХЙВеёЧтЦзЯдЪОга 5 жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЗхУцЛ§БШЮЊ 2ЁУ2ЁУ2ЁУ1ЁУ1 ЕФНсЙЙМђЪНЮЊ_____ЁЃ
Ђйгі FeCl3 ШмвКЯдзЯЩЋ ЂкЪєгкЗМЯузхЛЏКЯЮя ЂлФмЗЂЩњвјОЕЗДгІ
(5)ЩшМЦгУМзБНКЭввШЉЮЊдСЯжЦБИ ЕФКЯГЩТЗЯп_____(ЮоЛњЪдМСШЮбЁ)ЁЃ
ЕФКЯГЩТЗЯп_____(ЮоЛњЪдМСШЮбЁ)ЁЃ
ЁОД№АИЁПТШЦјЁЂЙтее аСШЉ ШЁДњЗДгІ ![]() +O2
+O2![]() +2H2O єЧЛљ
+2H2O єЧЛљ 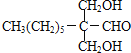 13
13 ![]()

ЁОНтЮіЁП
МзЭщКЭТШЦјдкЙтееЬѕМўЯТЗЂЩњШЁДњЗДгІЩњГЩD(CH2Cl2)ЃЌDдкЧтбѕЛЏФЦЕФЫЎШмвКЁЂМгШШЬѕМўЯТЗЂЩњШЁДњЗДгІЃЌЕЋЭЌвЛИіЬМдзгЩЯКЌгаСНИієЧЛљВЛЮШЖЈЛсЪЇЫЎЩњГЩШЉЃЌдђEЮЊHCHOЃЌCH3(CH2)6CHOКЭМзШЉЗДгІЩњГЩGЃЌИљОнЬтИјаХЯЂжЊGЃЌGЮЊ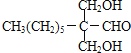 ЃЌGКЭЧтЦјЗЂЩњМгГЩЗДгІЩњГЩHЃЌHЮЊ
ЃЌGКЭЧтЦјЗЂЩњМгГЩЗДгІЩњГЩHЃЌHЮЊ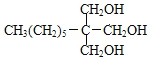 ЃЛМзБНдкЙтееЬѕМўЯТгыТШЦјЗЂЩњШЁДњЗДгІЩњГЩ
ЃЛМзБНдкЙтееЬѕМўЯТгыТШЦјЗЂЩњШЁДњЗДгІЩњГЩ![]() ЃЌ
ЃЌ![]() ЫЎНтЕУЕНAЃЌAЮЊ
ЫЎНтЕУЕНAЃЌAЮЊ![]() ЃЌAбѕЛЏЩњГЩBЃЌBЮЊ
ЃЌAбѕЛЏЩњГЩBЃЌBЮЊ![]() ЃЌBНјвЛВНбѕЛЏЩњГЩCЃЌCЮЊ
ЃЌBНјвЛВНбѕЛЏЩњГЩCЃЌCЮЊ![]() ЃЌCгыHЗЂЩњѕЅЛЏЗДгІЩњГЩIЮЊ
ЃЌCгыHЗЂЩњѕЅЛЏЗДгІЩњГЩIЮЊ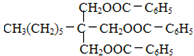 ЁЃОнДЫЗжЮіНтД№ЁЃ
ЁЃОнДЫЗжЮіНтД№ЁЃ
(1)ЗДгІЂйЪЧМзБНзЊЛЏЮЊ![]() ЃЌЫљашЪдМСЁЂЬѕМўЗжБ№ЪЧЃКТШЦјЁЂЙтееЃЛF[CH3(CH2)6CHO]ЕФУћГЦЮЊаСШЉЃЌЙЪД№АИЮЊЃКТШЦјЁЂЙтееЃЛаСШЉЃЛ
ЃЌЫљашЪдМСЁЂЬѕМўЗжБ№ЪЧЃКТШЦјЁЂЙтееЃЛF[CH3(CH2)6CHO]ЕФУћГЦЮЊаСШЉЃЌЙЪД№АИЮЊЃКТШЦјЁЂЙтееЃЛаСШЉЃЛ
(2)ЗДгІЂкЪЧC(![]() )гыH(
)гыH(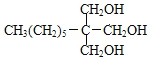 )ЗЂЩњЕФѕЅЛЏЗДгІЃЌвВЪєгкШЁДњЗДгІЃЛAЁњBЮЊБНМзДМЕФДпЛЏбѕЛЏЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК
)ЗЂЩњЕФѕЅЛЏЗДгІЃЌвВЪєгкШЁДњЗДгІЃЛAЁњBЮЊБНМзДМЕФДпЛЏбѕЛЏЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК![]() ЃЌЙЪД№АИЮЊЃКѕЅЛЏЗДгІЛђШЁДњЗДгІЃЛ
ЃЌЙЪД№АИЮЊЃКѕЅЛЏЗДгІЛђШЁДњЗДгІЃЛ![]() ЃЛ
ЃЛ
(3)GЕФНсЙЙМђЪНЮЊ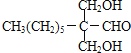 ЃЛHЮЊ
ЃЛHЮЊ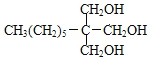 ЃЌЫљКЌЙйФмЭХЮЊєЧЛљЃЌЙЪД№АИЮЊЃК
ЃЌЫљКЌЙйФмЭХЮЊєЧЛљЃЌЙЪД№АИЮЊЃК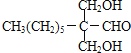 ЃЛєЧЛљЃЛ
ЃЛєЧЛљЃЛ
(4)ЛЏКЯЮяWЕФЯрЖдЗжзгжЪСПБШЛЏКЯЮяC(![]() )Дѓ14ЃЌWБШCЖр1ИіCH2дзгЭХЃЌWТњзуЯТСаЬѕМўЃКЂйгіFeCl3ШмвКЯдзЯЩЋЃЌЫЕУїКЌгаЗгєЧЛљЃЌЂкЪєгкЗМЯузхЛЏКЯЮяЃЌМДКЌгаБНЛЗЃЌЂлФмЗЂЩњвјОЕЗДгІЃЌЛЙКЌгаШЉЛљЃЌвђДЫТњзуЬѕМўЕФWЕФНсЙЙгаЃККЌга2ИіВрСДЮЊ-OHЁЂ-CH2CHOЃЌгаСкЮЛЁЂМфЮЛЁЂЖдЮЛ3жжЃЛКЌга3ИіВрСДЮЊ-OHЁЂ-CH3ЁЂ-CHOЃЌЖјOHЁЂ-CH3гаСкЁЂМфЁЂЖд3жжЮЛжУЃЌЖдгІЕФ-CHOЗжБ№га4жжЁЂ4жжЁЂ2жжЮЛжУЃЌЙЪЗћКЯЬѕМўЕФWЙВга3+4+4+2=13жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОга5жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЗхУцЛ§БШЮЊ2ЁУ2ЁУ2ЁУ1ЁУ1ЕФWЕФНсЙЙМђЪНЮЊЃК
)Дѓ14ЃЌWБШCЖр1ИіCH2дзгЭХЃЌWТњзуЯТСаЬѕМўЃКЂйгіFeCl3ШмвКЯдзЯЩЋЃЌЫЕУїКЌгаЗгєЧЛљЃЌЂкЪєгкЗМЯузхЛЏКЯЮяЃЌМДКЌгаБНЛЗЃЌЂлФмЗЂЩњвјОЕЗДгІЃЌЛЙКЌгаШЉЛљЃЌвђДЫТњзуЬѕМўЕФWЕФНсЙЙгаЃККЌга2ИіВрСДЮЊ-OHЁЂ-CH2CHOЃЌгаСкЮЛЁЂМфЮЛЁЂЖдЮЛ3жжЃЛКЌга3ИіВрСДЮЊ-OHЁЂ-CH3ЁЂ-CHOЃЌЖјOHЁЂ-CH3гаСкЁЂМфЁЂЖд3жжЮЛжУЃЌЖдгІЕФ-CHOЗжБ№га4жжЁЂ4жжЁЂ2жжЮЛжУЃЌЙЪЗћКЯЬѕМўЕФWЙВга3+4+4+2=13жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОга5жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЗхУцЛ§БШЮЊ2ЁУ2ЁУ2ЁУ1ЁУ1ЕФWЕФНсЙЙМђЪНЮЊЃК![]() ЃЌЙЪД№АИЮЊЃК13ЃЛ
ЃЌЙЪД№АИЮЊЃК13ЃЛ![]() ЃЛ
ЃЛ
(5)гУМзБНКЭввШЉЮЊдСЯжЦБИ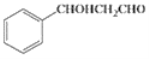 ЁЃБНгыТШЦјдкЙтееЬѕМўЯТЩњГЩ
ЁЃБНгыТШЦјдкЙтееЬѕМўЯТЩњГЩ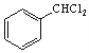 ЃЌШЛКѓЗЂЩњЫЎНтЗДгІЩњГЩ
ЃЌШЛКѓЗЂЩњЫЎНтЗДгІЩњГЩ ЃЌзюКѓгыввШЉдкМюадЬѕМўЯТЗДгІЩњГЩФПБъЮяЃЌКЯГЩТЗЯпСїГЬЭМЮЊЃК
ЃЌзюКѓгыввШЉдкМюадЬѕМўЯТЗДгІЩњГЩФПБъЮяЃЌКЯГЩТЗЯпСїГЬЭМЮЊЃК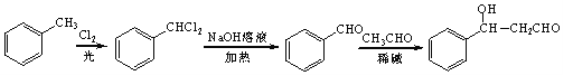 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЁЃ
ЁЃ


 БІБДМЦЛЎЦкФЉГхДЬЖс100ЗжЯЕСаД№АИ
БІБДМЦЛЎЦкФЉГхДЬЖс100ЗжЯЕСаД№АИ ФмПМЪдШЋФм100ЗжЯЕСаД№АИ
ФмПМЪдШЋФм100ЗжЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎФђЫи[CO(NH2)2]ЪЧШЫЙЄКЯГЩЕФЕквЛжжгаЛњЮяЁЃ
ЃЈ1ЃЉФђЫижаЫљКЌдЊЫиЕФЕчИКадзюДѓЕФЪЧ________ЃЌФђЫиЗжзгМфЕФЧтМќПЩБэЪОЮЊ_____ЁЃ
ЃЈ2ЃЉФђЫиПЩгУгкжЦгаЛњЬњЗЪЃЌжївЊДњБэга[Fe(H2NCONH2)6](NO3)3 ЁЃ
ЂйгыЬњЭЌжмЦкЧвЮДГЩЖдЕчзгЪ§гыFe3+ЯрЭЌЕФдЊЫиЪЧ________ЁЃ
Ђк[Fe(H2NCONH2)6](NO3)3жаВЛДцдкЕФЛЏбЇМќ____________ЃЈЬюађКХЃЉЁЃ
A РызгМќ B Н№ЪєМќ C ХфЮЛМќ D ІвМќ E ІаМќ
ЂлNO3ЃжаNдзгдгЛЏКѓЕФМлЕчзгХХВМЭМЮЊ_______ЃЌNO3ЃЕФПеМфЙЙаЭЮЊ________ЁЃ
IIЃЎMg2NiH4ЪЧвЛжжжќЧтЕФН№ЪєЧтЛЏЮя
ЃЈ3ЃЉMg2NiH4ПЩЭЈЙ§ЧтЛЏУОКЭФјЕЅжЪЧђФЅжЦГЩЁЃдкMg2NiH4ОЇАћжаЃЌNiдзгеМОнШчЭМЕФЖЅЕуКЭУцаФЃЌMg2+ДІгкЭМАЫИіаЁСЂЗНЬхЕФЬхаФЁЃ

ЂйMg2NiH4жаHЕФЛЏКЯМлЮЊ______ЁЃ
ЂкMg2+ЮЛгкNiдзгаЮГЩЕФ___________ЃЈЬюЁААЫУцЬхПеЯЖЁБЛђЁАЫФУцЬхПеЯЖЁБЃЉЁЃ
ЂлШєОЇЬхЕФУмЖШЮЊdgЁЄcmЃ3ЃЌMg2NiH4ЕФФІЖћжЪСПЮЊMgЁЄmolЃ1ЃЌдђMg2+КЭNiдзгЕФзюЖЬОрРыЮЊ___________nmЃЈгУКЌdЁЂMЕФДњЪ§ЪНБэЪОЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІНјааЗжРрЪБЃЌМШЪєгкбѕЛЏЛЙдЗДгІгжЪєгкЛЏКЯЗДгІЕФЪЧЃЈ ЃЉ
A.2FeCl2+Cl2=2FeCl3B.Zn+H2SO4=ZnSO4+H2Ёќ
C.CO2+CaO=CaCO3D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАбЮТЖШЮЊ20ЁцЃЌХЈЖШЮЊ1.0molЁЄLЃ1ЕФH2SO4КЭ2.2molЁЄLЃ1ЕФМюШмвКИї50mlЛьКЯ(ШмвКУмЖШОљЮЊ1gЁЄmlЃ1ЃЌБШШШШнЮЊ4.184kJЁЄKЃ1ЁЄkgЃ1)ЃЌЧсЧсНСЖЏЁЃВтЕУЫсМюЛьКЯвКЕФЮТЖШБфЛЏЪ§ОнШчЯТЃЌдђЗДгІNH3ЁЄH2O=NH4++OHЃЕФьЪБфдМЮЊ(ЕЅЮЛЃКkJЁЄmolЃ1)
ЗДгІЮя | Ц№ЪМЮТЖШT1/Ёц | жежЙЮТЖШT2/Ёц |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3ЁЄH2O | 20 | 32.6 |
A. +2.1 B. +52.7 C. ;+4.2 D. -4.2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДМЪЧвЛжжПЩдйЩњФмдДЃЌОпгаПЊЗЂКЭгІгУЕФЙуРЋЧАОАЃЌЙЄвЕЩЯвЛАуПЩВЩгУШчЯТЗДгІРДКЯГЩМзДМЃКCO(g)+2H2(g) ![]() CH3OH(g) ЁїH
CH3OH(g) ЁїH
ЃЈ1ЃЉЛЏбЇЦНКтГЃЪ§БэДяЪНЮЊK=___________________ЁЃ
ЃЈ2ЃЉЯТЭМЪЧИУЗДгІдкВЛЭЌЮТЖШЯТCOЕФзЊЛЏТЪЫцЪБМфБфЛЏЕФЧњЯпЁЃ

Ђй ИУЗДгІЕФьЪБфІЄH______0(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃ
Ђк T1КЭT2ЮТЖШЯТЕФЦНКтГЃЪ§ДѓаЁЙиЯЕЪЧK1____________K2(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃ
Ђл ШєШнЦїШнЛ§ВЛБфЃЌЯТСаДыЪЉПЩдіМгМзДМВњТЪЕФЪЧ_________ЁЃ
a. Щ§ИпЮТЖШ b. НЋCH3OH(g)ДгЬхЯЕжаЗжРы
c. ЪЙгУКЯЪЪЕФДпЛЏМС d. ГфШыHeЃЌЪЙЬхЯЕзмбЙЧПдіДѓ
ЃЈ3ЃЉвбжЊдкГЃЮТГЃбЙЯТЃКЂй 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ІЄH ЃН-a kJЁЄmol-1Ђк 2CO(g)+O2(g)=2CO2(g) ІЄH ЃН-b kJЁЄmol-1Ђл H2O(g)= H2O(l) ІЄHЃН-c kJЁЄmol-1ЃЌдђЃЌCH3OH(l)+O2(g) =CO(g)+2H2O(l)ІЄHЃН___kJЁЄmol-1ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОЃЌФГЛЏбЇаЁзщФтгУИУзАжУжЦШЁДПОЛЕФO2ЁЃ

(1)ШєCЪЧвЛжжЕЛЦЩЋЙЬЬхЃЌдђЩеЦПжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___ЁЃ
(2)ШєCЪЧвЛжжКкЩЋЗлФЉЃЌдђBЪЧ_________ЃЌCЕФзїгУЪЧ________________ЁЃ
(3)ЙуПкЦПжаЪЂзАЕФЪдМСDЪЧ___________ЃЌЦфзїгУЪЧ______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаМьбщЗНЗЈКЭНсТле§ШЗЕФЪЧ
A.ЯШМгШыЯЁбЮЫсЃЌдйЕЮМгЯѕЫсвјШмвКгаАзЩЋГСЕэЩњГЩЃЌдђдШмвКжавЛЖЈгаClЃ
B.МгШыТШЛЏБЕШмвКгаАзЩЋГСЕэЩњГЩЃЌдђдШмвКжавЛЖЈгаSO![]()
C.МгШыХЈNaOHШмвККѓМгШШЃЌВњЩњФмЪЙЪЊШѓЕФКьЩЋЪЏШяЪджНБфРЖЩЋЕФЦјЬхЃЌдђдШмвКжагаNH4+
D.МгШызЯЩЋЪЏШяЪдвКЃЌШмвКЯдКьЩЋЃЌжЄУїШмвКвЛЖЈГЪМюад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌЯђвЛШнЛ§ЮЊ5 LЕФКуШнУмБеШнЦїжаГфШы0.4 mol SO2КЭ0.2 mol O2ЃЌЗЂЩњЗДгІЃК2SO2(g)+O2(g)![]() 2SO3(g) ІЄHЃНЃ196 kJ/molЁЃЕБЗДгІДяЕНЦНКтЪБЃЌШнЦїФкбЙЧПБфЮЊЦ№ЪМЪБЕФ0.7БЖЁЃЧыЛиД№ЯТСаЮЪЬтЃК
2SO3(g) ІЄHЃНЃ196 kJ/molЁЃЕБЗДгІДяЕНЦНКтЪБЃЌШнЦїФкбЙЧПБфЮЊЦ№ЪМЪБЕФ0.7БЖЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1 ЃЉХаЖЯИУЗДгІДяЕНЦНКтзДЬЌЕФБъжОЪЧ___________(ЬюзжФИ)ЁЃ
AЃЎSO2ЁЂO2ЁЂSO3Ш§епЕФХЈЖШжЎБШЮЊ2ЁУ1ЁУ2 BЃЎШнЦїФкЦјЬхЕФбЙЧПВЛБф
CЃЎШнЦїФкЛьКЯЦјЬхЕФУмЖШБЃГжВЛБф DЃЎSO3ЕФЮяжЪЕФСПВЛдйБфЛЏ
EЃЎSO2ЕФЩњГЩЫйТЪКЭSO3ЕФЩњГЩЫйТЪЯрЕШ
ЃЈ2ЃЉЂйSO2ЕФзЊЛЏТЪЃН_______________ЃЛЂкДяЕНЦНКтЪБЗДгІЗХГіЕФШШСПЮЊ____________kJЃЛЂлДЫЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§KЃН__________ЁЃ
ЃЈ3ЃЉгвЭМБэЪОЦНКтЪБSO2ЕФЬхЛ§ЗжЪ§ЫцбЙЧПКЭЮТЖШБфЛЏЕФЧњЯпЃЌдђЃК

ЂйЮТЖШЙиЯЕЃКT1________T2(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБЃЌЯТЭЌ)ЃЛ
ЂкЦНКтГЃЪ§ЙиЯЕЃКKA_________KBЃЌKA_________KDЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋвЛЖЈСПАБЛљМзЫсяЇМгШыКуШнШнЦїжаЃКNH2COONH4(s)![]() 2NH3(g)+CO2(g)ЁЃИУЗДгІЕФЦНКтГЃЪ§ЕФИКЖдЪ§(-lgK)жЕЫцЮТЖШ(T)ЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
2NH3(g)+CO2(g)ЁЃИУЗДгІЕФЦНКтГЃЪ§ЕФИКЖдЪ§(-lgK)жЕЫцЮТЖШ(T)ЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
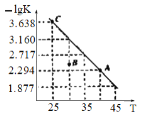
A. ИУЗДгІЕФЩњГЩЮязмФмСПДѓгкЗДгІЮязмФмСП
B. ДІгкAЕуЕФCO2ЕФЯћКФЫйТЪДѓгкДІгкCЕуЕФCO2ЯћКФЫйТЪ
C. BЕуЪБЃЌvФц>vе§
D. CO2ЕФЬхЛ§ЗжЪ§ВЛБфЪБЗДгІвЛЖЈДяЕНЦНКтзДЬЌ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com