
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,W的单质是黄绿色气体,X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式_____________。
(2)成外高一化学兴趣小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)__________;若装置D中装的是铁粉,当通入W2时观察到的现象为______________;若装置D中装的是催化剂,当通入YX2时,打开K通入适量X2,化学反应方程式为___________________;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)________________,可以看到白色沉淀生成,其原因分别为________________________________________________________________________。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)若由元素Y和X组成 酸根Z(Y2X32-),当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,该反应的离子方程式为_____________________________________________________________________。
【答案】MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O 相同 产生棕黄色的烟 2SO2+O2
Mn2++Cl2↑+2H2O 相同 产生棕黄色的烟 2SO2+O2![]() 2SO3 5Cl2+I2+6H2O=2HIO3+10HCl AC 当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀 S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+
2SO3 5Cl2+I2+6H2O=2HIO3+10HCl AC 当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀 S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+
【解析】
W的单质是黄绿色气体,则W为氯(Cl),X的单质只有氧化性,则X不可能是氟,只能是氧(O),从而得出Y为硫(S),YX2为SO2,W2为Cl2。
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的离子方程式为MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O。答案为:MnO2+4H-+2Cl-
Mn2++Cl2↑+2H2O。答案为:MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①分别通入SO2和Cl2,它们都能使品红溶液褪色,所以在装置A中观察到的现象相同;若装置D中装的是铁粉,当通入Cl2时,二者发生反应生成FeCl3,观察到的现象为产生棕黄色的烟;若装置D中装的是催化剂,当通入SO2时,打开K通入适量O2,发生反应生成SO3,化学反应方程式为2SO2+O2![]() 2SO3。答案为:相同;产生棕黄色的烟;2SO2+O2
2SO3。答案为:相同;产生棕黄色的烟;2SO2+O2![]() 2SO3;
2SO3;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,则1molI2参加反应失去10mole-,I由0价升高到+5价,即生成HIO3,同时Cl2转化为Cl-,该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl。答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管,由于反应生成BaSO3和HCl的量很少,所以未见沉淀生成,若要看到有沉淀生成,要么加碱中和HCl,促使平衡正向移动,要么加入强氧化剂,将BaSO3转化为BaSO4,所以向该试管中加入过量A(氨水)、C(稀硝酸),都可以看到白色沉淀生成,其原因分别为:当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀。答案为:A、C;当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀;
(4)若由元素Y和X组成S2O32-,当Cl2与含S2O32-的溶液完全反应后,有浅黄色S沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,则生成BaSO4,表明原溶液中含有SO42-,该反应的离子方程式为S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+。答案为:S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+。


科目:高中化学 来源: 题型:
【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下,则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1)
反应物 | 起始温度T1/℃ | 终止温度T2/℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
A. +2.1 B. +52.7 C. ;+4.2 D. -4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵加入恒容容器中:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
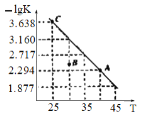
A. 该反应的生成物总能量大于反应物总能量
B. 处于A点的CO2的消耗速率大于处于C点的CO2消耗速率
C. B点时,v逆>v正
D. CO2的体积分数不变时反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
____________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.因SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.向 50 mL 18.4 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量小于0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于5.6
D.等物质的量的SO2和Cl2混合后通入装有湿润有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com