
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有
(填化学式)
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为 、 、
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差):
(1)Ba(NO3)2、AgNO3(2分,只答AgNO3不得分)
(2)BaCl2,K 2CO3,HCl (3分)
(3)烧杯、玻璃棒、漏斗(2分)
(4)取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量(2分)
(5)不可靠,所得KCl晶体并非完全来自原样品(2分)
解析试题分析:(1)硫酸根离子和碳酸根离子都会干扰氯离子的检验(硫酸银,碳酸银也是白色沉淀),所以先加过量的硝酸钡除去碳酸根离子和硫酸根离子,再加硝酸银如果得到不溶于稀硝酸的白色沉淀就说明含有氯离子。(2)除杂不引杂,引入的杂质还要除去。碳酸钾应放在氯化钡的后面除去多余的钡离子,而盐酸应放在碳酸钾的后面除去多余的碳酸根离子。(3) 步骤①和②属于过滤操作所用的玻璃仪器胶头滴管,
烧杯、玻璃棒、漏斗.(4)如果没有过量再加氯化钡还会有浑浊,否则就没有现象。(5)不可靠,因为氯化钡和碳酸钾中引入了氯离子和钾离子,所以会偏高。
考点:本题考查离子的反应和的除杂及具体的操作及意事项。


科目:高中化学 来源: 题型:实验题
某活动小组对CuSO4分解产物除CuO外的气体的3种可能性进行假设,并通过实验确定气体的物质的量。
(1)气体的3种可能性为 ; ;有SO2、SO3和O2。
(2)为确定SO2、SO3和O2的物质的量之比,请你选用所给的仪器进行实验,按气体从左至右的方向连接各装置。顺序为: →B。(已知SO3溶于浓硫酸) 
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为: 、 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是_ 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为 ;
列式计算该成品的纯度 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过碳酸钠(2Na2CO4·3H2O)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下:
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液显 (填“酸性”、“碱性”或“中性”)。请用离子方程式表示:______________________。
(2)操作①需要的玻璃仪器有 (填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的__________(选填序号)。
a. 氢氧化钡溶液 b. 稀硝酸 c. 硫氰化钾溶液 d. 硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若观察到 说明装置不漏气。
③装置A的作用是 ,装置C中的试剂为 。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要? (选填“必要”或“不必要”),判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。
(1)过程①的实验操作名称是____________,____________。
(2)上述过程中,属于氧化还原反应的是_______,离子方程式为 。
(3)过程③的实验操作名称是___________和___________;在此过程中,可供选择的有
机溶剂是_______(填字母代号)。
| A.酒精 | B.CCl4 | C.苯 | D.醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式: 。
(2)上图装置中NaOH溶液的作用是_ 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有___ _(填写化学式)。
(3)步骤二中,水浴加热所需仪器有__ _、_ (加热、夹持仪器、石棉网除外);
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法:
(5)影响产品产量的主要因素有__ __。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO实验流程如下:
请回答下列问题:
(1)加入铁粉后发生反应的离子方程式为_________________________________。
(2)甲、乙两同学选用下列仪器,采用不同的方法来制取氨气。
A B
①甲同学使用的药品是熟石灰与氯化铵,则应选用装置_______(填写装置代号),生成氨气的化学方程式为_______________________________________;
②乙同学选用了装置B,则使用的两种药品的名称为_______________。
(3)H2O2的作用是____________________________________________________。
(4)除铁过程中得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂(K2FeO4),该反应中氧化剂与还原剂的物质的量之比为____________。
(5)乙知溶液a中含有CO32-、SO42-两种酸根阴离子,若只允许取用一次样品,检验这种离子存在的实验操作过程为________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用如图实验装置精制粗溴。
①图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:
已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。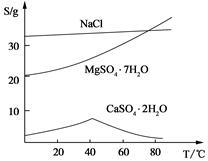
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com