
【题目】某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
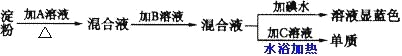
请回答下列问题:
① 所加入的试剂分别是
A_______,B________,C________;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
【答案】稀 H2SO4 NaOH 银氨溶液 是为了中和硫酸,使银氨溶液与水解液发生反应 部分
【解析】
淀粉在酸性条件下水解生成葡萄糖,加碱中和之后溶液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖;淀粉遇碘单质变蓝。
(1)淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,由水解后的溶液加碘水变蓝,则说明水解不完全。
故答案为:稀H2SO4;NaOH;银氨溶液;
(2)加NaOH溶液的作用是中和稀硫酸,使混合液呈碱性,银镜反应需在碱性条件下进行,
故答案为:是为了中和硫酸,使银氨溶液与水解液发生反应;
(3)加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,由水解后的溶液加碘水变蓝,则说明水解不完全,
故答案为:部分。


科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1:请回答下列问题:
2SO3(g) ΔH=-196.6kJ·mol-1:请回答下列问题:
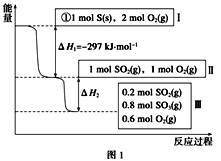
(1)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|___(填“大”、“小”或“相等”)。
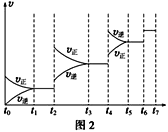
(2)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是___;图中表示平衡混合物中SO3的含量最高的一段时间是____。
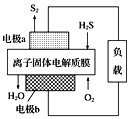
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。则电极b上发生的电极反应为___;电路中每通过4mol电子,在负极消耗___L(标况)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,Cl—Cl键的键能为bkJ·mol-1,PCl3中P—Cl键的键能为ckJ·mol-1,P4的结构为![]() 。则P—P键的键能为
。则P—P键的键能为
A.(a-6b+12c)/6kJ·mol-1B.(a-3b+12c)/4kJ·mol-1
C.(a-6b-12c)/6kJ·mol-1D.(a-3b-12c)/4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,正确的是
A.平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
B.已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
C.有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
D.有气体参加的反应达到平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热。
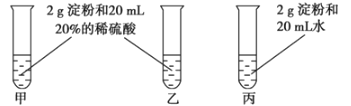
待试管甲中的溶液冷却后再进行后续实验。
实验①:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验②:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验③:取少量丙中溶液加入氢氧化钠溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式_____________________。
(2)设计甲和乙是为了探究________对淀粉水解的影响,设计甲和丙是为了探究________对淀粉水解的影响。
(3)实验①失败的原因是_____________________________。
(4)实验③中溶液的颜色无明显变化的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院大连化学物理研究所储能技术研究部的研究团队在碱性锌铁液流电池研究方面取得新进展,该电池的总反应为![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
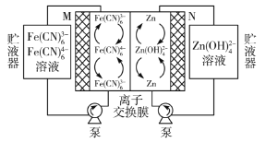
A.放电时,M为电池正极,电极反应式为![]() +e-=
+e-=![]()
B.充电时,N接电池负极,该电极发生还原反应
C.放电时,右侧贮液器中溶液浓度增大
D.放电时,电路中转移2mol电子时,负极区电解质溶液增重65g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原是在有催化剂的条件下将NOx转变为N2和H2O,这是目前国外硝酸厂进行尾气治理普遍采用的一种方法,某小组同学拟验证NO能被氨气还原并测算其转化率。
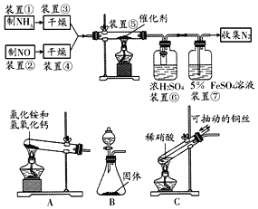
请回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为_______,若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是______、________;
(2)用C装置制取NO时,用可抽动的铜丝,其优点是_______,其反应的离子方程式为________;
(3)装置⑦的作用可能是____________;
(4)若进入装置⑤的NO共2688mL(标况下),氨气过量,最后收集到标况下2016mLN2,则NO的转化率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com