
【题目】已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,Cl—Cl键的键能为bkJ·mol-1,PCl3中P—Cl键的键能为ckJ·mol-1,P4的结构为![]() 。则P—P键的键能为
。则P—P键的键能为
A.(a-6b+12c)/6kJ·mol-1B.(a-3b+12c)/4kJ·mol-1
C.(a-6b-12c)/6kJ·mol-1D.(a-3b-12c)/4kJ·mol-1
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
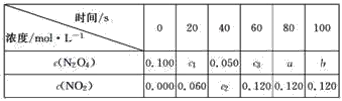
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和1/2 mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用右图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系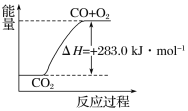
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除![]() 外其它原子均满足8电子稳定结构。下列说法正确的是
外其它原子均满足8电子稳定结构。下列说法正确的是
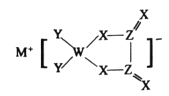
A.M的单质通常保存在煤油中B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>YD.上述五种元素中Z的电负性最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
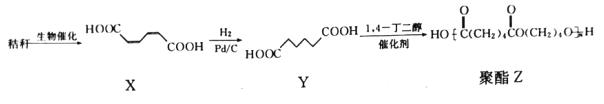
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯的催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式如下:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正×x(CH3COOCH3) ×x(C6H13OH),v逆=k逆×x(CH3COOC6H13) ×x(CH3OH),其中是k正、k逆为速率常数(受温度影响),x为各组分的物质的量分数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1:1投料,测得338K、343K、348K三个温度下CH3COOCH3转化率(![]() )随时间(
)随时间(![]() )的变化关系如图所示。下列说法正确的是
)的变化关系如图所示。下列说法正确的是
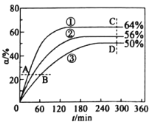
A.该反应的△H>0
B.348K时,该反应的平衡常数为1.8
C.A、B、C、D四点中,v正最大的是D
D.在曲线①、②、③中,k正与k逆的差值最大的曲线是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器中进行下列可逆反应:C(s)+H2O(g)![]() CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
A.①②③B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
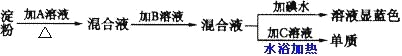
请回答下列问题:
① 所加入的试剂分别是
A_______,B________,C________;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
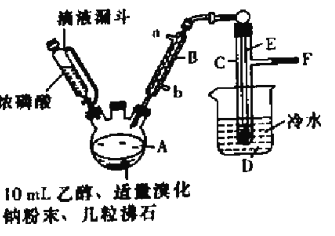
【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置),反应原理为:H3PO4(浓)+NaBr![]() +NaH2PO4+HBr,CH3CH2OH+HBr
+NaH2PO4+HBr,CH3CH2OH+HBr![]() CH3CH2Br+H2O, 有关数据见下表:
CH3CH2Br+H2O, 有关数据见下表:
物质名称 | 乙醇 | 溴乙烷 | 溴 |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中加入沸石的作用是______________________.
(2)仪器B的名称为____________,该仪器的进水口为_______(填“a”或“b”)口.
(3)实验中用滴液漏斗代替分液漏斗的优点为_________________
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?_________(用化学方程式表示).
(5)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是______(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com