
| 该元素相对原子质量×该元素原子个数 |
| 物质的相对分子质量 |
| 150×40% |
| 12 |
| 150×6.7% |
| 1 |
| 150-12×5-10 |
| 16 |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
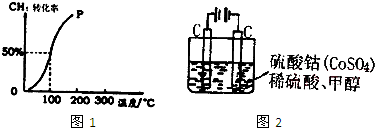
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | H+ | K+ | NO3-[来源:.Com] | SO42- |
| 物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
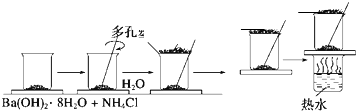 在研究化学反应中的能量变化时,我们通常做下面的实验:在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2?8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
在研究化学反应中的能量变化时,我们通常做下面的实验:在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2?8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的红色石蕊试纸变蓝的气体产生,此气体为 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com