
【题目】下图中分别是两种烃的结构模型:
A.  B.
B. 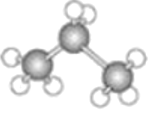
请回答下列问题:
(1)A、B两种模型分别是有机物的____________模型和____________模型。
(2)模型A可以表示分子中原子的相对位置和相对大小,以下物质的空间结构可以用模型A表示的是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)已知:模型B表示某烃M的结构。该烃与氯气反应生成另一有机物N,且M和N的式量相差34.5。
①写出M的结构简式:__________________。
②N的可能结构有______种。若N的分子中有2种不同化学环境的氢原子,则该过程的化学方程式是______________________________,此反应的类型是__________________。
【答案】比例 球棍 AB ![]() 答案见解析
答案见解析 ![]() 取代反应
取代反应
【解析】
⑴A、B两种模型分别是有机物的球棍模型和比例模型,球棍模型突出的是原子之间的成键的情况及空间结构,比例模型突出的是原子之间相对大小以及原子的大致连接顺序、空间结构,不能体现原子之间的成键的情况,故答案为:比例,球棍;
⑵中间是碳原子,周围四个原子要比碳原子小,只有A和B符合题意,故答案为:A、B;
⑶
①白色球为氢原子,黑色球为碳原子,所以该烃的结构简式为![]() ,故答案为
,故答案为![]() ;
;
②该烃与氯气反应生成另一有机物N,且M和N的式量相差34.5,故N为M的一氯代物,M的一氯代物可能为![]() 、
、![]() ,该过程的化学方程式是
,该过程的化学方程式是![]() 或
或![]() ,属取代反应,故答案为:2,
,属取代反应,故答案为:2, ![]() 或
或![]() ,取代反应。
,取代反应。


科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A.5.2g 26 Al3+中所含的电子数约为1.204×1024
B.10 Be和9 Be是中子数不同、质子数相同的不同原子
C.26 Al3+和26 Mg2+的质子数、中子数和核外电子数都不相同
D.10 Be原子核内的中子数比质子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
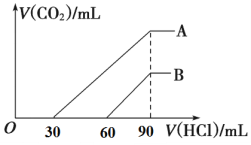
(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述错误的是 ( )
A. 标准状况下,气态烷烃的密度不可能大于3g/L
B. 常温常压下,碳原子相同的液态烷烃,至少含3种结构
C. 室温下,固态烷烃的密度都小于水,会浮在水面上
D. 烷烃的热稳定性都较差,受热一定会分解成C和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。回答下列问题:
(1)硅元素最外层有______种能量不同的电子,有______种运动状态不同的电子,写出其最外层电子的电子排布式__________________。
(2)![]() 的空间构型和
的空间构型和![]() 相同,写出
相同,写出![]() 的电子式:__________________。
的电子式:__________________。
(3)部分短周期元素化合价与原子序数的关系可用图示表示。

①元素X在元素周期表中的位置是__________________。
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:______________________________。
③第三周期主族元素中非金属性最强的两种元素是____________和____________(填元素符号),用一个化学方程式说明这两种元素非金属性的相对强弱:______________________________。
(4)第三同期元素的原子所形成的简单离子中:还原性最弱的阴离子是____________;氧化性最强的阳离子是____________。
(5)写出两种W的含氧酸的化学式____________、____________,设计一种实验方案比较两种酸的酸性强弱,写出反应的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1:1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H_____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL﹣1s﹣1。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T_____100℃(填“大于”或“小于”),判断理由是_____________。

(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com