
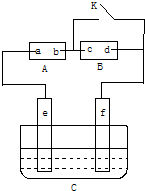
 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
| ||
| ||
| 1.92g×2mol |
| 64g |


科目:高中化学 来源: 题型:
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ |
| B、若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C、若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同 |
| D、平衡时Ⅰ容器的体积小于V L |
查看答案和解析>>
科目:高中化学 来源: 题型:
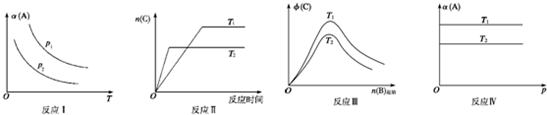
| A、反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行 |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应III:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
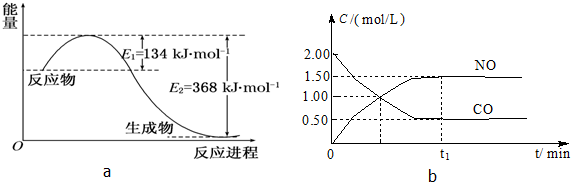
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 0.75 | 1.5 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg12C所含有的碳原子数为NA个 |
| B、NA的近似值为6.02×1023 |
| C、1 mol H2O含有的H2O分子数目为NA个 |
| D、NA个Cl2的质量为35.5 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com