
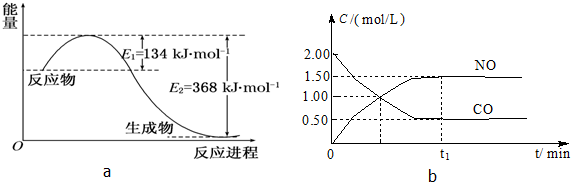
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 0.75 | 1.5 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
| △c |
| △t |
| 1.50mol/L |
| t1min |
| 1.50 |
| t1 |
| 1.50 |
| t1 |
| 1.50 |
| t1 |
| 1.5×1.5 |
| 0.5×0.5 |
| b |
| 2 |


科目:高中化学 来源: 题型:
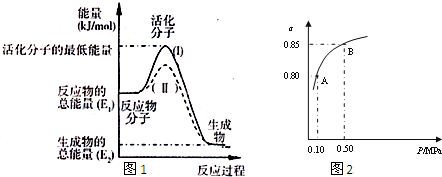
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol?L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠(s) |
| B、硫酸钠(s) |
| C、醋酸钠(s) |
| D、硫酸铵(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
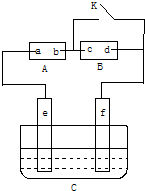 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移向Zn极,阳离子移向Cu极 |
| B、移向Cu极,阳离子移向Zn极 |
| C、和阳离子都移向Zn极 |
| D、和阳离子都移向Cu极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的硫蒸汽和硫固体分别完全燃烧,后者放出热量多 |
| B、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l);△H=-285.8kJ/mol |
| C、在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol,则稀醋酸溶液与稀氢氧化钠溶液混合,中和热仍为57.3kJ/mol |
| D、由C(石墨)→C(金刚石):△H=+119kJ/mol可知,石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑧⑨ |
| B、①②③⑤⑧⑨ |
| C、①②③⑤⑥⑦⑧ |
| D、①②③⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用排饱和食盐水法收集Cl2:Cl2+H2O?H++Cl-+HClO |
| B、热的纯碱溶液碱性增强:CO32-+2H2O?H2CO3+2OH- |
| C、向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+═2 Fe(OH)3(s)+3Mg2+ |
| D、配制FeCl3溶液时为防止溶液浑浊加入少量稀盐酸Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com