
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol?L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
| 催化剂 |
| △ |
| c(I3-)?c2(SO42-) |
| c3(I-)?c(S2O82-) |
| c(I3-)?c2(SO42-) |
| c3(I-)?c(S2O82-) |
| 1 |
| 4 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、10 mL |
| B、5 mL |
| C、大于5 mL |
| D、小于5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ |
| B、若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C、若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同 |
| D、平衡时Ⅰ容器的体积小于V L |
查看答案和解析>>
科目:高中化学 来源: 题型:
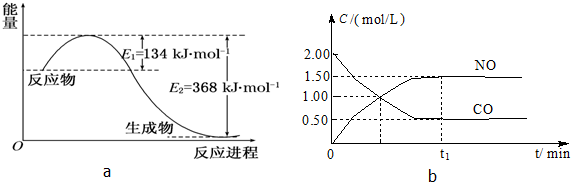
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 0.75 | 1.5 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com