
| A、移向Zn极,阳离子移向Cu极 |
| B、移向Cu极,阳离子移向Zn极 |
| C、和阳离子都移向Zn极 |
| D、和阳离子都移向Cu极 |
科目:高中化学 来源: 题型:
| A、10 mL |
| B、5 mL |
| C、大于5 mL |
| D、小于5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、③④ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
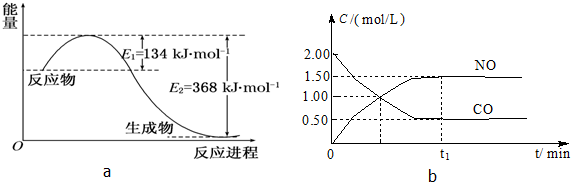
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 0.75 | 1.5 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C、CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
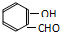 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( 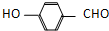 )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )| A、前者>后者 | B、前者<后者 |
| C、前者=后者 | D、无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2与稀H2SO4反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、饱和碳酸钠溶液中通入足量CO2 CO32-+H2O+CO2═2HCO3- |
| C、C12与NaOH溶液反应 Cl2+2OH-═C1-+C1O-+H2O |
| D、把金属铁放入稀硫酸中 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com