
A、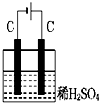 |
B、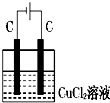 |
C、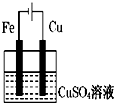 |
D、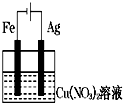 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、500mL 2.0mol?L-1 HCl和500mL 2.0mol?L-1 NaOH的反应符合图1,且△E=57.3kJ |
| B、500mL 2.0mol?L-1 H2SO4和500mL 2.0mol?L-1 Ba(OH)2的反应符合图2,且△E=114.6kJ |
| C、CaO、浓硫酸溶于水时的能量变化符合图1 |
| D、发生图1能量变化的任何反应,一定不需加热即可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移向Zn极,阳离子移向Cu极 |
| B、移向Cu极,阳离子移向Zn极 |
| C、和阳离子都移向Zn极 |
| D、和阳离子都移向Cu极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、反应物和生成物各自具有的总能量决定反应是放热还是吸热 |
| C、任何放热反应在常温条件下一定能发生 |
| D、镁和氧气反应生成氧化镁后,生成物能量明显升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①③ |
| C、①③④ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
| B、1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA |
| C、各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| D、24 g镁与足量的盐酸或NaOH溶液反应转移的电子数目均为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com