
| mg |
| 188g/mol |
| m |
| 94 |
| ||
| 0.1L |
| 5m |
| 47 |
| 5m |
| 47 |
| 3.76g |
| 188g/mol |
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ʊ���Һ�����������л���Na2CO3���� |
| B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ |
| C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ |
| D���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ |
| E��δ�ñ�Һ��ϴ��ʽ�ζ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����� | B������������ |
| C������ | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
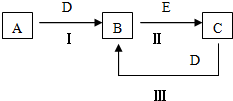 A��B��C��D��EΪ��ѧ��ѧ�����ĵ��ʻ���ת����ϵ��ͼ��ʾ��
A��B��C��D��EΪ��ѧ��ѧ�����ĵ��ʻ���ת����ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����0.45mol |
| B������0.45mol |
| C����0.45mol ��0.9mol֮�� |
| D������0.9mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10 mL |
| B��5 mL |
| C������5 mL |
| D����5 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cl- |
| B��OH- |
| C��AlO2- |
| D��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2A+3B=2C |
| B��A+3B=2C |
| C��3A+B=2C |
| D��A+B=C |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com