
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有____________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
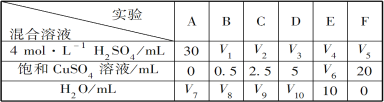
请完成此实验设计,其中:V1=___________,V6=___________,V9=___________;
反应一段时间后,实验A中的金属呈___________色,实验E中的金属呈___________色;
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________。
【答案】(1)CuSO4+Zn===ZnSO4+Cu,Zn+H2SO4===ZnSO4+H2↑(各1分)
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率(2分)
(3)Ag2SO4(2分)
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种即可) (2分)
(5)①30 10 17.5 (各1分) ②灰黑 暗红 (各1分)
③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积(2分)
【解析】
试题分析:(1)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,CuSO4与Zn反应产生的Cu与Zn形成Cu—Zn原电池,加快了氢气产生的速率,有关反应的方程式为CuSO4+Zn===ZnSO4+Cu,Zn+H2SO4===ZnSO4+H2↑。
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4。
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等。
(5)①要研究硫酸铜的量对氢气生成速率的影响,必须做对比实验,除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V1=30mL,V6=10mL,V9=17.5mL。
②反应一段时间后,实验A中锌只与稀硫酸反应,则金属呈灰黑色,实验E中有铜生成,则金属呈暗红色;
③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,则加入的CuSO4较多时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积,导致氢气的生成速率下降。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质。通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/L r溶液的![]() 为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
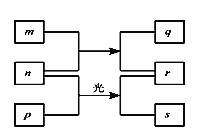
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.![]() 的氢化物常温常压下为气态
的氢化物常温常压下为气态
D.![]() 的最高价氧化物对应的水化物为弱酸
的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,化学性质稳定,用途广泛。 工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬及获得强氧化性 Na2Cr2O7,其工艺流程如下图所示:
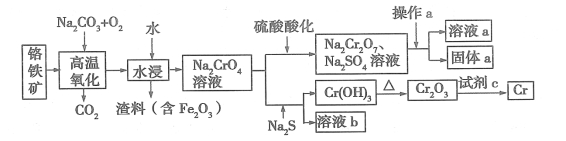
 (1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(2)写出利用铝热反应制取铬的化学方程式: ,试剂 c 通常还可以是 (至少写两种) 。
(3)酸化过程中,不选用盐酸的原因是 。
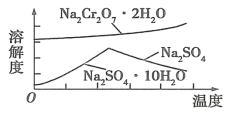
(4)固体 a 的主要成分是 Na2SO4·10H2O,根据图分析,操作a为 、 、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
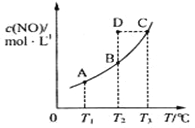
A.该反应的△H>0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】84消毒液的pH为10.1,最适宜的测定方法是
A. 使用pH试纸 B. 使用红色石蕊试纸
C. 使用数字pH计 D. 以酚酞为指示剂进行酸碱中和滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁![]() 是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),写出反应方程式:_________________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-) 。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是
A. 用可见光束照射以区别溶液和胶体
B. 将NH4Cl溶液蒸干制备NH4Cl固体
C. 用萃取分液的方法除去酒精中的水
D. 只滴加氨水鉴别NaCl、A1Cl3、MgCl2、Na2SO4四种溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com