
【题目】我国科技工作者运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法错误的是( )
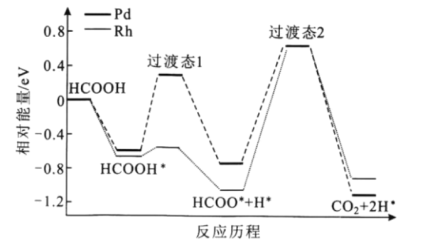
A.HCOOH吸附在催化剂表面是一个放热过程
B.Pd、Rh作催化剂时HCOOH分解产生H2的反应热不同
C.该反应过程中有C-H键的断裂,还有C=O键的生成
D.HCOO*+H*=CO2+2H*是该历程的决速步骤
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
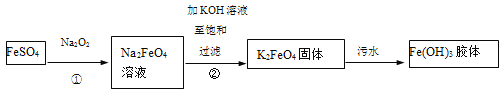
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2其原理如图所示,正确的是( )
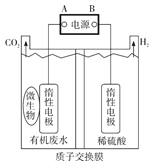
A. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B. 电源A极为负极
C. 通电后,若有22.4LH2生成,则转移2mol电子
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图:
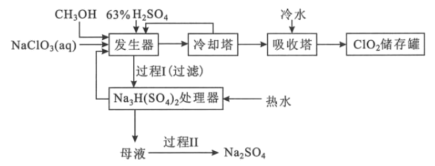
回答下列问题:
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。
(2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。
(3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。
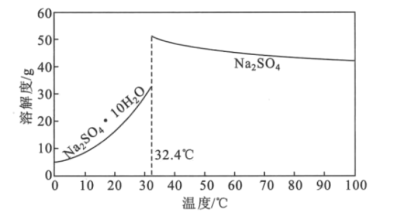
(4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。
(5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。
(6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
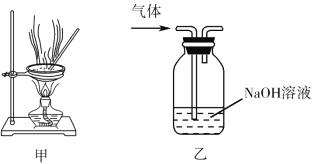
A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(仅含三种短周期元素)是一种络合氢化物的储氢材料,在400℃下分解,放出氢气。X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究A的组成和性质,设计并完成了如下实验。(金属互化物--全部由金属元素组成的化合物)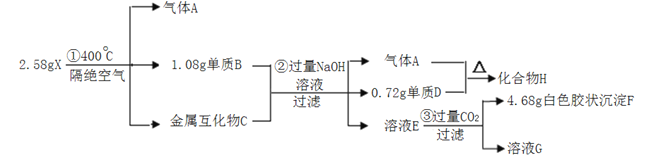
(1)写出单质D对应的阳离子结构示意图:_____。
(2)X在400℃下分解的化学方程式:_____。
(3)写出单质B与NaOH溶液反应的离子方程式:____。
(4)化合物H___(填“可能”或“不可能”)与水发生反应产生H2,判断理由_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com