
【题目】下列各物质的转化关系如下图所示.B、D是气体,其中B是空气的主要成分之一;C是淡黄色固体,常用于供氧剂;E是红棕色固体;F是最常见的无色液体. 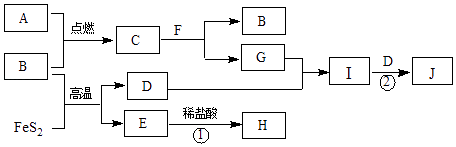
回答下列问题:
(1)C的化学式是 .
(2)气体D通入紫色石蕊溶液的现象是 .
(3)写出反应①的离子方程式 .
(4)写出反应②的化学方程式 .
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸、水、乙醇等溶剂.某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙. 
(1)请选择必要的装置,按气流方向连接顺序为 . (填仪器接口的字母编号,装置可重复使用)
(2)根据完整的实验装置进行实验,实验步骤如下:①检查装置气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后, ,
. (填操作);④拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO28H2O↓+2NH4+ , 在碱性环境中制取CaO28H2O的装置如图: 
①装置A中发生反应的化学方程式为 .
②NH3在Ca2+和H2O2的反应历程中所起的作用是 .
③反应结束后,经过滤、洗涤、低温烘干可获得CaO28H2O.检验CaO28H2O是否洗涤干净的操作为 .
④已知CaO2在350℃迅速分解生成CaO和O2 . 若所取产品的质量为m g,加热至恒重时,剩余固体n g,则产品中CaO2的质量分数为(用字母表示):
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现汽车尾气的合理排放:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)△H<0,若反应在恒容的密闭容器中进行,下列说法正确的是( )
N2(g)+2CO2(g)△H<0,若反应在恒容的密闭容器中进行,下列说法正确的是( )
A.随着反应的进行,容器内压强始终不变
B.及时地分离出N2或CO2 , 正反应速率加快
C.升高温度(其它条件不变),可提高反应物的转化率
D.使用不同催化剂(其它条件不变),该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3 , 不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),流程如图: 
(1)滤渣Ⅰ的主要成分是(填化学式).
(2)还原时,试剂X若选用SO2 , 则反应后的阴离子是(填化学式).
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是、、过滤、洗涤、干燥.
(4)七水合硫酸亚铁(FeSO47H2O) 在医学上常用作补血剂.某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量. 步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4﹣+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL.
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要、 .
②该补血剂中亚铁离子的含量为mg/片 (请写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易燃、易爆、腐蚀性等化学物质在其包装上应贴有危险警告标签,下列物质贴错标签的是
A | B | C | D | |
物质的化学式 | 浓H2SO4 | CCl4 | P4 | NH4NO3 |
危险警告标签 | 腐蚀品 | 易燃品 | 剧毒品 | 爆炸品 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用影响化学反应速率的外界条件来解释的是( )
A. 镁和锌分别与相同浓度的盐酸反应,镁产生H2的速率快
B. 铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO
C. 用加热的方法可以将水中溶解的O2和N2赶出
D. 面粉加工厂内充满粉尘,遇火易发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.3g钠与水反应产生组气的分子数为0.05NA
B.28gN2和N4组成的混合气体中含有的原子数为3NA
C.0.1 molL﹣1Na2SO4溶液含有0.1NA个SO42﹣
D.22.4L氯气中含有的电子总数一定为34NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
(1)利用△H﹣T△S判断,该反应在条件下自发进行(填“高温”“低温”、或“任何温度”).
(2)计算500℃时该反应的平衡常数K= . CO 的平衡转化率为 .
(3)下列措施可增大甲醇产率的是 . A.压缩容器体积 B.将CO(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(4)可判断可逆反应达到平衡状态的依据是 . A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.容器中CO、H2、CH3OH的物质的量之比为1:2:1
E.混合气体压强不再随时间变化而变化
(5)若其它条件不变,使反应在300℃下进行,在上图中作出甲醇的物质的量浓度随时间的变化的示意图. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com