
����Ŀ��ʵ�����Ʊ���ˮ�Ҵ���������ʵ�鲽�����¡�
��.��������ͼ��ʾ����100mLԲ����ƿ�м���10gС����״����ʯ�Һ������������ƣ�����ע��50mL��ҵ�Ҵ�������1h��
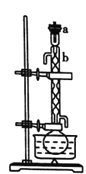
��.������ͼ��ʾ��������ϣ�����ƿ��ȴ������ƿ�м��뼸����ʯ����Ϊ����װ�ã��ռ�78��ʱ����֣���Ϊ��ˮ�Ҵ���(�á���ʾ�ƾ���)��
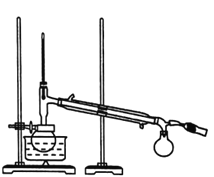
�Իش��������⣺
(1)װ��b��������________��
(2)��������ƿ�м�����ʯ�ҵķ���____________��
(3)����![]() ������Ϊ�˳�ȥ��ҵ�Ҵ���������ȩ�������ķ�ӦΪ
������Ϊ�˳�ȥ��ҵ�Ҵ���������ȩ�������ķ�ӦΪ![]() ���÷�Ӧ�ķ�Ӧ����Ϊ_______������1h��Ŀ����________��
���÷�Ӧ�ķ�Ӧ����Ϊ_______������1h��Ŀ����________��
(4)����ʱ�����¶ȼ�ʾ��Ϊ78������ʱ��β�ӹ��г���Һ�Σ���ȥ��ʼ������Һ�壬ԭ����_______��
(5)��ͬѧ���������Ϊ���ˣ���ش���˷�����ԭ����_____��
���𰸡�(����)������ ����ƿ��ţ���ֽ��(��ҩ��)���������뵽��ƿ�ײ���������ֱ����ƿ �ӳɷ�Ӧ ʹ![]() ��
��![]() ��ȩ��ȩ��ַ�Ӧ ��ʼ������Һ���к��еͷе������ ��������ȥ�ܽ����Ҵ��е��л����
��ȩ��ȩ��ַ�Ӧ ��ʼ������Һ���к��еͷе������ ��������ȥ�ܽ����Ҵ��е��л����
��������
(1)���������Ľṹ��֪��װ��b��������(����)�����ܣ��ʴ�Ϊ��(����)�����ܣ�
(2)����ҩƷ���ӹ����֪������ƿ�м�����ʯ�ҵķ����ǽ���ƿ��ţ���ֽ��(��ҩ��)���������뵽��ƿ�ײ���������ֱ����ƿ���ʴ�Ϊ������ƿ��ţ���ֽ��(��ҩ��)���������˵���ƿ�ײ���������ֱ����ƿ��
(3)��Ӧ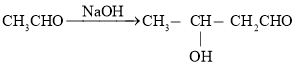 Ϊȩ���ļӳɷ�Ӧ���������Իӷ������ʻص���ƿ�м������뷴Ӧ��ʹ
Ϊȩ���ļӳɷ�Ӧ���������Իӷ������ʻص���ƿ�м������뷴Ӧ��ʹ![]() ��
��![]() ��ȩ��ȩ��ַ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��ʹ
��ȩ��ȩ��ַ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��ʹ![]() ��
��![]() ��ȩ��ȩ��ַ�Ӧ��
��ȩ��ȩ��ַ�Ӧ��
(4)���ڿ�ʼ������Һ���к��еͷе�����ʣ����������ʱ�����¶ȼ�ʾ��Ϊ78������ʱ��β�ӹ��г���Һ�Σ�Ҫ��ȥ��ʼ������Һ�壻�ʴ�Ϊ����ʼ������Һ���к��еͷе�����ʣ�
(5)��������ȥ�ܽ����Ҵ��е��л���ȣ��ʹ��˷����ף��ʴ�Ϊ����������ȥ�ܽ����Ҵ��е��л��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������࣬�����������й���ġ������л���������ȷ���ǣ� ��
A.![]() 2������3����Ȳ
2������3����Ȳ
B. 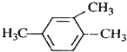 1��3��4�����ױ�
1��3��4�����ױ�
C. CH3��C��CH3��=CH��CH3 3������2����ϩ
D.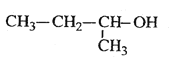 2������
2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������д��ȷ���ǣ� ��
A. ������ĵ��뷽��ʽ��HClO===H++ClO��
B. �������ռ���Һ�����ӷ���ʽ��Al+2OH��==AlO2��+H2��
C. ��⾫��ͭ��������Ӧʽ��Cu��2e��==Cu2+
D. ��֪�к���Ϊ57.3 kJ��mol��1��ϡ��������������ϡ��Һ��Ӧ���Ȼ�ѧ����ʽ��H2SO4 (aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ��H=��114.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���Ԫ��֮һ�����ĵ��ʼ��仯�������ʶ�������;�㷺��
(1)��ԭ�Ӻ�������Ų�ʽΪ_________�����������ӹ���_____�ֲ�ͬ����չ����
(2)N2������һ�ּ��������о���ֵ�ķ��ӣ����Ŀռ�ṹ��ͼ����һ����������ṹ(![]() ),��N4��һ��_____________���ӡ�������ԡ��Ǽ��ԡ�)
),��N4��һ��_____________���ӡ�������ԡ��Ǽ��ԡ�)
(3)��ѧ�������о����ô������������ٷɻ�β���е�NO��COת��ΪCO2��N2:2NO+2CO ![]() 2CO2 + N2+Q ( Q��0)���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___________���¶����ߣ�Kֵ________��ѡ��� ������С���������䡱)����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��_____________________��
2CO2 + N2+Q ( Q��0)���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___________���¶����ߣ�Kֵ________��ѡ��� ������С���������䡱)����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��_____________________��
(4)���ο��������ʣ�ʵ���Ҽ�������е� NH4+ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ___________________��˵����NH4+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10��5 | Ka1=4.3��10��7 Ka2=5.6��10��11 | Ka=3.0��10��8 |
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��������Һ��pH��С�������е�˳����_______���ñ����д��
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
��2�������£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����_____������ĸ��_______
A. c��H+�� B.![]() C. c��H+��c��OH���� D.
C. c��H+��c��OH���� D. ![]() E.
E. ![]()
��3��д�������������Һ��ͨ������������̼�����ӷ���ʽ��__________________
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��
c��CH3COO������c��Na+��=________����ȷ��ֵ����
��5��25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ____________________________________
��6����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ�� c��OH����=2c��H2CO3��+_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ҷ�������Һ����Ʒ��ǩ������Ϣ��ͼ��ʾ���Ҷ����Ľṹ��ʽΪHOCH2CH2OH���������ѧ֪ʶ���������й۵㲻��ȷ����

A. �Ҷ������������Ϊͬϵ��
B. ���Ҷ����ͱ�������Ϊ��������ˮ���л���
C. ��ϩ���Ҷ�������ʹ���Ը��������Һ��ɫ����ԭ����ͬ
D. һ�������£��Ҷ����������������������ò���ķ���ʽΪC6H12O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ؿ��γɺܶ���Ҫ�Ļ�������е������ƣ�NaN3�����㷺Ӧ����������ȫ���ҡ��������Ƶ���ȡ������:�ٽ�������Һ̬����Ӧ��NaNH2��NaNH2��N2O�����ʵ���2:1��Ӧ������NaN3��NaOH��һ�����塣
(1)��д����Ӧ�ڵĻ�ѧ����ʽΪ:____________��
(2)��N3-��Ϊ�ȵ�����ķ����У�______��дһ�֣��ɴ˿���֪N3-�Ŀռ乹����:_________�� �Ƚ�NH2-��NH3�ļ��ǡ�HNH�Ĵ�С��NH2- ____ NH3(����>������<������=��)�����ü۲���ӶԻ�����ɽ���_______��
(3)�������ƣ�NaN3���ֽ�ɵô�N2���й�˵����ȷ����:________��ѡ����ţ�
A�����������º��ȶ�������Ϊ��Ԫ�صĵ縺�Դ�
B��NaN3��KN3�ṹ���ƣ�ǰ�߾����ܽ�С
C����һ�����ܣ�I1����N��P��S
D�����ȶ���NH3ǿ��PH3��H2S����ΪNH3���Ӽ������
(4)С�����ķ�ײ�����е������ƵĹ���ԭ���ǻ��ڷ�Ӧ��6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 �������������ֶѻ���ʽ���������ֶѻ���ʽ�ֱ���ͼ�ס�ͼ����ʾ���侧����������ͼ��ʾ����
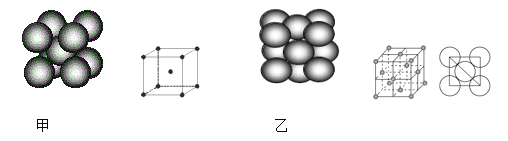
����������ԭ�ӵ���λ��Ϊ��_______������������ԭ�ӵĶѻ���ʽΪ��________������������ԭ�Ӱ뾶Ϊa cm��NA��ʾ�����ӵ�������Ħ������ΪM g/mol����þ�����ܶȿɱ�ʾΪ��___________ g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ������
(1)�ڶ������У���һ�����ܽ���B��N֮���Ԫ�ع���_________�֡�
(2)���������У�ԭ�Ӻ�������Ų�������δ�ɶԵ��ӵ�Ԫ����_________�֡�
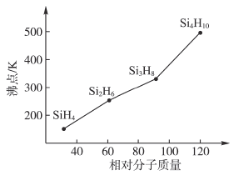
(3)����(Si��H2H2n��2)�ķе�������Է��������ı仯��ϵ��ͼ��ʾ���������ֱ仯��ϵ��ԭ����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��״����CH4�����Ϊ4.48L������������ʵ���Ϊ___________��������Ϊ___________�� ԭ����ԼΪ___________��������Ϊ___________��������Ϊ___________��Ħ������Ϊ___________������Ϊ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com