
【题目】已知标准状况下CH4的体积为4.48L,该气体的物质的量为___________,分子数为___________, 原子数约为___________,质子数为___________,电子数为___________,摩尔质量为___________,质量为___________。
科目:高中化学 来源: 题型:
【题目】实验室制备无水乙醇常用蒸馏法,实验步骤如下。
Ⅰ.回流。如图所示,在100mL圆底烧瓶中加入10g小颗粒状的生石灰和少量氢氧化钠,慢慢注入50mL工业乙醇,回流1h。
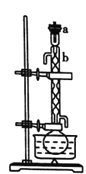
Ⅱ.蒸馏。如图所示,回流完毕,待烧瓶冷却后在烧瓶中加入几粒沸石,改为蒸馏装置,收集78℃时的馏分,即为无水乙醇。(用△表示酒精灯)。
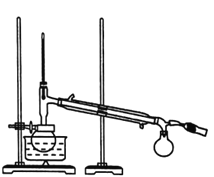
试回答下列问题:
(1)装置b的名称是________。
(2)简述向烧瓶中加入生石灰的方法____________。
(3)加入![]() 固体是为了除去工业乙醇中少量的醛,发生的反应为
固体是为了除去工业乙醇中少量的醛,发生的反应为![]() ,该反应的反应类型为_______,回流1h的目的是________。
,该反应的反应类型为_______,回流1h的目的是________。
(4)蒸馏时,待温度计示数为78℃左右时,尾接管中出现液滴,弃去开始流出的液体,原因是_______。
(5)有同学建议改蒸馏为过滤,请回答过滤法不妥的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
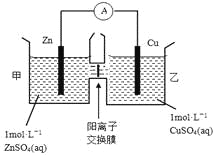
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L的密闭容器中加入0.60molX(g),发生反应X(g)![]() Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)0~3min内用Z表示的平均反应速度v(Z)=___。
(2)分析该反应中反应物的浓度与时间的关系,得出的结论是___。由此规律推出在6min时反应物X的浓度为___mol·L-1。
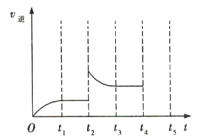
(3)该反应的逆反应速率随时间变化的曲线如图所示,t2时改变的条件可能是___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),下列说法正确的是( )

A.![]()
B.![]()
C.![]() 的非金属性依次减弱,所以途径II吸收的热量依次增多
的非金属性依次减弱,所以途径II吸收的热量依次增多
D.生成相同物质的量![]() 放出的热量比生成
放出的热量比生成![]() 的多,说明
的多,说明![]() 比
比![]() 稳定
稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/L NaOH溶液滴定分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00 mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:
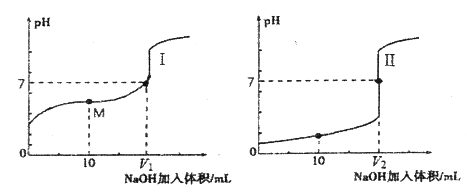
(1)滴定醋酸的曲线是_____________(填“Ⅰ”或“Ⅱ”)。
(2)下列方法中可使溶液中醋酸的电离程度减小的是_____________(填字母序号)。
A. 微热溶液 B. 加少量冰醋酸
C. 加少量醋酸钠固体 D. 加少量碳酸钠固体
(3)V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
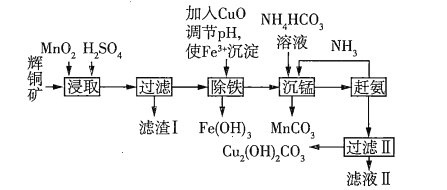
(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com