
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
| ���� | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| �ܶȻ� | 2.8��10�C9 | 6.8��10�C6 | 5.5��10�C6 | 1.8��10�C11 |
(1)����(1��)�� ������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܽ�ȱ�MgCO3���ܽ��С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3(2��)�� CaCO3 CaO + CO2��(2��)�� (2)����(1��)��
CaO + CO2��(2��)�� (2)����(1��)��
��(1��)�� CO32�C + Mg2+ = MgCO3��MgCO3 + 2OH�C = Mg(OH)2 + CO32�C(4��) (3)10(2��)
�������������(1)������ĥ�ɷ�ĩ����CaCO3��CaCO3���ܶȻ���MgCO3���ܶȻ�С�����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3��Ӧ���������ճ�CaO��CaOͶ�뺣ˮ�����ɵ�Ca(OH)2ʹ��ˮ�е�Mg2+ת��ΪMg(OH)2������(2)NaOH�������OH�C����Mg2+��Ӧ����Mg(OH)2������Mg(OH)2���ܶȻ�MgCO3���ܶȻ�������ͨ�����ռӦ��MgCO3����ת��ΪMg(OH)2������MgCO3 + 2OH�C = Mg(OH)2 + CO32�C��(3)Ksp[Mg(OH)2]=c(Mg2+)��c2(OH�C)=1.8��10�C3��c2(OH�C)=1.8��10�C11�������c(OH�C)=1��10�C4����pH=10��
���㣺����������ת�����ܶȻ����йؼ��㡢���ӷ���ʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����£���Ũ�Ⱦ�Ϊ1 mol��L��1������4����Һ��
��H2SO4��Һ ��NaHCO3��Һ ��NH4Cl��Һ ��NaOH��Һ
��1����4����ҺpH�ɴ�С��˳���� ��������ˮ�����H��Ũ����С���� ����������ţ�
��2�����и�����Ũ���ɴ�С��˳���� ��NaHCO3��ˮ��ƽ�ⳣ��Kh�� mol��L��1������֪̼��ĵ��볣��K1��4��10��7��K2��5.6��10��11��
��3�������ͨ��������������ʱ ��ֵ �����������С�����䡱����
��ֵ �����������С�����䡱����
��4�������ۺܻ͢�Ϻ���Һǡ�ó����ԣ�����ǰ�۵���� �ܵ����������ڡ�����С�ڡ����ڡ�֮һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������, Ũ�Ⱦ�Ϊ0. 1 mol/L��6����Һ��pH���±�:
| ��� | a | b | c | d | e | f |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ95 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���95��ʱ0.1 mol��L��1��NaOH��Һ�У���ˮ������� c(H��)= mol��L��1��Kw(25 ��) Kw(95��)(�>������<������)��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl ���壬��ˮ�ĵ���ƽ���Ӱ���� (��ٽ����������ơ���Ӱ�족)��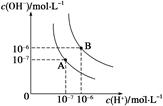
��2��25��ʱ����0.1L 0.2 mol��L-1��HA��Һ�У���0.001mol��HA��������ӣ������Һ��pH= �������Ϊ ��
��3������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ ��
| ��ѧʽ | ����ƽ�ⳣ��(25 ��) |
| HCN | K��4.9��10��10 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��25��ʱ��ijNaCl��Һ��c(Cl�C)��1��10��4 mol��L�C1�������Һ��c(Na��)��c(OH��)��
��2��25��ʱ����0.1 mol��L�C1NaOH��Һ��0.06 mol��L�C1��H2SO4��Һ��������(���Ի�Ϻ�����ı仯)����������Һ��pH�� ��25��ʱ��pHֵΪ8��NaOH��Һ��pHֵΪ10��NaOH��Һ�������Ϻ���Һ��������Ũ����ӽ� ��
��3��25��ʱ������������Һ�У���pH=0������ ��0.1 mol��L�C1������ ��0.01 mol��L�C1��NaOH��Һ ��pH=11��NaOH��Һ����ˮ��������������Ũ��֮�Ȣ٩U�کU�۩U���ǣ� (����ĸ)
| A��1�U10�U100�U1000 | B��0�U1�U12�U11 |
| C��14�U13�U12�U11 | D��14�U13�U2�U3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊ��֤��������������ʣ��ס��ҡ��������˷ֱ�ѡ�������Լ�����ʵ�飺
0��1 mol��L��1������Һ��pH��3�����ᡢpH��3�Ĵ��ᡢ������ˮ��п����pH��ֽ�ȡ�
(1)��ȡ��10 mL0��1 mol��L��1������Һ����pH��ֽ�����pH��a��ȷ��������������ʣ���aӦ������Ĺ�ϵ��_________��������__________________________________��
(2)�ҽ�pH��3��������ᣬ��ȡ1 mL��������ˮϡ�͵�100 mL��Ȼ����pH��ֽ
�ֱ�ⶨ����Һ��pH������϶�������������ʣ��жϵ�������______________________________��
(3)���ֱ�ȡpH��3������ʹ���10 mL��Ȼ��ֱ����������ͬ��п��������ų�H2��ƽ������ ����족�������������϶�������������ʣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��X��Y��Z��W�������ʵ�ˮ��Һ�����Ƿֱ���Na2CO3��NaOH��CH3COOH��NaCl�е�һ�֡���֪X��Y����Һ��ˮ�ĵ���̶���ͬ��X��Z����Һ��pH��ͬ����ش��������⣺
��1��X�� ��Z�� ��
��2��Z��W����Һ��ˮ�ĵ���̶��ɴ�С��˳��Ϊ ���û�ѧʽ��ʾ����
��3��д��Z��Һ�����Y��Һ��Ӧ�����ӷ���ʽ ��
��4��X��Y����Һǡ����ȫ��Ӧ����Һ�и�����Ũ���ɴ�С��˳����
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��������SO2�������ᵼ����ˮ�к��У��ѧʽ������ ��Σ��ֲ��ͽ���������ŷŵ�SO2β���ñ���Na2SO3��Һ���տɵõ���Ҫ����ԭ��NaHSO3����Ӧ�Ļ�ѧ����ʽΪ ��
��2����֪NaHSO3��ˮ��Һ�����ԣ��Ƚ�����SO32����HSO3����H2SO3�������ӵ�Ũ�ȣ� >����������������>������������������
��3��SO2�ǿ������������ָ��֮һ������SO2��ԭKIO3����I2�ķ�Ӧ�ⶨ������SO2������ÿ����0.01mol I2���μӷ�Ӧ��SO2Ϊ�� ����mol��
��4����֪25��ʱ��Ksp(BaSO4)��1.1��10-10��Ksp (BaCO3)��2.6��10-9������˵������ȷ����
A��25��ʱ����BaSO4����Һ�м������ˮ��Ksp(BaSO4)����
B��25��ʱ����BaSO4����Һ�м���Na2CO3��Һ��BaSO4������ת��ΪBaCO3
C����Na2SO4�м������BaCl2��Һ����Һ��c(SO42��)����Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�ᡢ����ǻ�ѧ�������о�����Ҫ������ش����и�С�⣺��1��ij��Ԫ��H2X�ĵ��뷽��ʽ�ǣ�H2X=H++HX����HX�� X2��+H+���ش��������⣺
X2��+H+���ش��������⣺
��KHX��Һ�� ������ԡ��������ԡ������ԡ�����
����0.1 mol��L��1KHX��Һ��pH=2����0.1 mol��L��1H2X��Һ�������ӵ����ʵ���
Ũ�� �����������������=����0.11 mol��L��1�������� ��
��0.01 mol��L��1��HCl��0.02 mol��L��1��KHX��Һ��������Һ�и�����Ũ���ɴ�С��˳����  ��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4��
��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4��
��3����25���£���pH��3�Ĵ�����Һ��pH��11������������Һ����������������Һ�����ʵ���Ũ���� ��������Һ�����ʵ���Ũ�� �����������������������������������Һ���ʵ���Ũ�ȡ�����������Һ�������ϣ���Ӧ����Һ�� ����ᡱ����������С����ԡ�
��4��ijǿ���Է�Ӧ��ϵ�У�������Ӧ��
X+ PbO2+ H2SO4 = Pb��MnO4��2+ PbSO4+ H2O ��
��֪X��һ�������Σ���0.2 mol X�ڸ÷�Ӧ��ʧȥ1 mol ���ӣ���X�Ļ�ѧʽ��
���뽫������ѧ����ʽ��ƽ����ϵ�����ڸ�����ǰ�ĺ����ϡ�.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com