
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700900℃时,O2可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
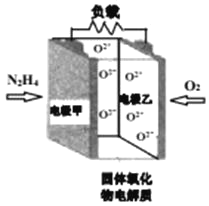
A.电池内的O2由电极乙移向电极甲
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有lmolN2H4消耗时,乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
【答案】A
【解析】
该燃料电池中,通入燃料的一极为负极,则电极甲为负极,通入氧气的一极为正极,电极乙为正极,反应生成物均为无毒无害的物质,则负极上N2H4失电子发生氧化反应生成氮气,电极反应式为:N2H4+2O24e=N2↑+2H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+4e=2O2,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答。
该燃料电池中,通入燃料的一极为负极,则电极甲为负极,通入氧气的一极为正极,电极乙为正极,反应生成物均为无毒无害的物质,则负极上N2H4失电子发生氧化反应生成氮气,电极反应式为:N2H4+2O24e=N2↑+2H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+4e=2O2,电池总反应为:N2H4+O2=N2↑+2H2O,
A. 原电池中,阴离子向负极移动,即O2由电极乙移向电极甲,A项正确;
B. 由以上分析知,电池总反应为:N2H4+O2=N2↑+2H2O,B项错误;
C. 由电池总反应为:N2H4+O2=N2↑+2H2O可知,当甲电极上有1molN2H4消耗时,乙电极上有1molO2被还原,状况不知,所以体积不一定是22.4LO2,C项错误;
D. 电池外电路的电子由负极移向正极,所以由电极甲移向电极乙,D项错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有c(CH3COOH)+c(CH3COO)=0.1 mol·L1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是
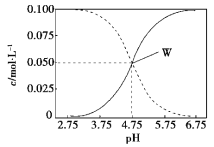
A. pH=5.5的溶液中:c(CH3COO—)>c(CH3COOH)>c(H+)>c(OH)
B. pH=3.5的溶液中:c(Na+)+c(H+)c(OH)+c(CH3COOH)=0.1 mol·L1
C. W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)
D. 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的有几项![]()
![]() 固体与稀硝酸混合:
固体与稀硝酸混合:![]()
![]() 用过量氨水吸收烟道气中的
用过量氨水吸收烟道气中的![]() :
:![]()
![]() 将少量
将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
![]() 已知
已知![]() ,向NaClO溶液中通入少量
,向NaClO溶液中通入少量![]() :
:![]()
![]() 铁屑溶于足量稀硝酸:
铁屑溶于足量稀硝酸:![]()
![]() 氯气溶于水:
氯气溶于水:![]()
![]() 实验室用
实验室用![]() 和
和![]() 制氨气:
制氨气:![]()
![]()
![]()
![]() 向
向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好沉淀完全:
恰好沉淀完全:![]()
![]() 实验室制
实验室制![]() :
:![]() 浓
浓![]() 十
十![]()
![]()
![]()
![]() 溶液刻蚀铜制电路板:
溶液刻蚀铜制电路板:![]()
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:①量取25.00mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-
滴定次数 | 待测液的体积/mL | 0.1000mol·L-1 Na2S2O3的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
试回答:
(1)消耗Na2S2O3的体积平均值为___mL,水中溶解氧的量是(以g/L为单位,保留3位有效数字)___。
(2)滴定(I2和S2O32-反应)以淀粉溶液为指示剂,终点时现象为___。
(3)判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质___。
④待测液的滴定管之前有气泡,取液后无气泡___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
B.向![]() 溶液中通入少量CO2:2
溶液中通入少量CO2:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO
+CO![]()
C.向[Ag(NH3)2]OH溶液中加入盐酸:Ag++Cl-=AgCl↓
D.向稀硝酸中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把SO2通入盛有H2S的溶液中出现淡黄色浑浊,该反应的化学方程式为____________________。
(2)将二氧化硫通入氯化钡溶液无现象,滴入新制的氯水有白色沉淀生成,写出反应的离子方程式:_________________________。
(3)硫酸亚铁铵[(NH4)2Fe(SO4)2]隔绝空气加热至500℃时能完全分解,分解产物中含有氧化铁、二氧化硫、氨气、氮气和水蒸气,反应的化学方程式为__________________。
(4)向氯化铜溶液中通入SO2,加热生成CuCl白色沉淀,离子方程式为___________________。
(5)把氧气通入Cu与浓硫酸反应后剩余的溶液中,铜片继续溶解,反应的化学方程式为________________________________________。
(6)①磷化氢(PH3)通入盛有Fe2(SO4)3溶液的试管中,颜色由棕黄色变成淡绿色,同时还有白色蜡状固体生成,反应的离子方程式是____________________。
②PH3有剧毒,用CuSO4溶液吸收,生成物中有Cu3P、H3PO4,写出反应的化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应关系正确的是![]()
操作和现象 | 结论 | |
A | 常温下,将Al箔插入浓 | 铝和浓硝酸不反应 |
B | 向饱和 | 析出了 |
C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 向装有 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com