
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700900℃时,O2可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
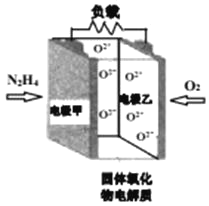
A.电池内的O2由电极乙移向电极甲
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有lmolN2H4消耗时,乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:
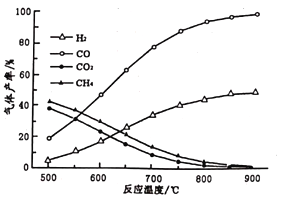
①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在1L密闭容器中加amolSO2和bmolO2发生反应2SO2+O2![]() 2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
(1)生成___molSO3;
(2)O2的转化率为___;
(3)平衡时容器内气体的总物质的量为___mol;
(4)达到平衡时,c(SO2)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如图所示,回答下列问题:
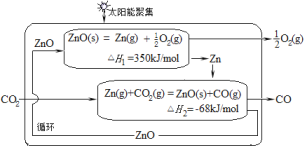
(1)①Zn/ZnO在反应中循环使用,其作用是___。
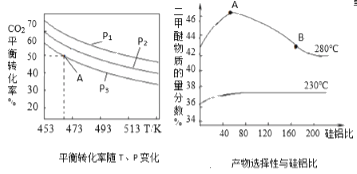
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g),
CH3OCH3(g)+3H2O(g),![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示。图中A点和B点的化学平衡常数比较:KA___KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对含+4价硫元素的物质性质进行探究,实验方案和步骤如下:
ⅰ组 | ⅱ组 | ⅲ组 | |||
| 步骤一 | 试管 | 0.3g纯净Na2SO3(s) | 0.3g纯净Na2SO3(s)+1.17gNaCl(s) | |
滴管 | 10mL2molL-1 盐酸 | 10mL2molL-1 HNO3 | 10mL2molL-1HNO3 | ||
现象 | 均有无色气泡产生且遇空气无颜色变化 | ||||
步骤二 | 滴管 | 在上述溶液中,分别滴加4滴0.1molL-1BaCl2溶液 | |||
现象 | 4min后溶液变浑浊 | 2.5h后溶液变浑浊 | 20min后溶液变浑浊 | ||
已知Na+的存在对该实验无影响,则关于上述实验的描述,不正确的是( )
A.步骤一中产生气体的反应为SO2
B.实验ⅰ中的难溶物为BaSO3
C.由实验可知:含+4价硫元素的物质可被O2氧化
D.通过实验ⅰ和ⅲ、ⅱ和ⅲ的对比,可知:NO3-或Cl-的存在对溶液中+4价硫元素的氧化速率有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯气有氧化性,可使干燥布条漂白褪色
B.常温下,铁、铝不与浓硫酸反应,因此可用铁、铝容器贮存运输浓硫酸
C.已知电离能力H2CO3>HClO>![]() ,则向氯水中加入碳酸氢钠晶体,能提高溶液中HClO的浓度
,则向氯水中加入碳酸氢钠晶体,能提高溶液中HClO的浓度
D.向BaCl2溶液中通入SO2可产生白色浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g) ![]() N2O3(g)+O2(g)
N2O3(g)+O2(g)
②N2O3(g) ![]() N2O(g)+O2(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
A. 1.8mol/L B. 0.9 mol/L C. 2.3 mol/L D. 4.0 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com