
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如图所示,回答下列问题:
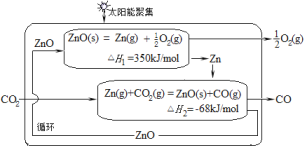
(1)①Zn/ZnO在反应中循环使用,其作用是___。
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g),
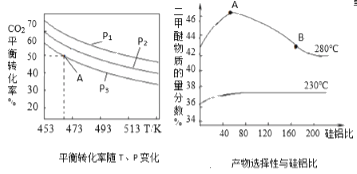
CH3OCH3(g)+3H2O(g),![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示。图中A点和B点的化学平衡常数比较:KA___KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:___。
【答案】= 温度越高,二甲醚的选择性越大 低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小
【解析】
(1)Zn/ZnO在反应中循环使用,反应中为中间产物,起到催化剂的作用;
(2)平衡常数只受温度影响,280℃下A点和B的K相等,通过对比可知230℃的曲线变化相对平缓,280℃的曲线变化程度较大且先升后降,280℃二甲醚物质的量分数较大,温度升高,浓度的变化受影响的程度也会有一定的改变。
(1)Zn/ZnO在反应中循环使用,反应中为中间产物,起到催化剂的作用;
(2)平衡常数只受温度影响,280℃下A点和B的K相等,通过对比可知230℃的曲线变化相对平缓,280℃的曲线变化程度较大且先升后降,280℃二甲醚物质的量分数较大,温度升高,浓度的变化受影响的程度也会有一定的改变,因此变化规律可归纳为:①温度越高,二甲醚的选择性越大;②低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
B.向![]() 溶液中通入少量CO2:2
溶液中通入少量CO2:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO
+CO![]()
C.向[Ag(NH3)2]OH溶液中加入盐酸:Ag++Cl-=AgCl↓
D.向稀硝酸中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
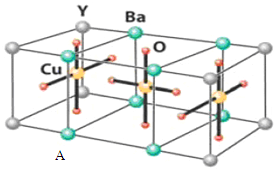
【题目】HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为__________________。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于________晶体,与![]() 互为等电子体的分子的化学式__________(写1种),
互为等电子体的分子的化学式__________(写1种),![]() 的电子式为_________,其中心原子的杂化类型是________________。
的电子式为_________,其中心原子的杂化类型是________________。
(4)![]() 中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
(5)治癌药物B的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们占据三个周期。Y原子最外层电子数是电子层数的3倍。同由W、X、Z和SO42-组成一种离子化合物的水溶液中滴加稀氢氧化钠溶液,产生沉淀与加入的氢氧化钠溶液的体积关系如图所示。下列说法正确的是( )
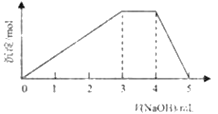
A.X、Y两种元素的非金属性强,其单质化学性质也很活泼
B.Z与X、Y形成的常见盐含有离子键和极性共价键
C.Z的最高价氧化物对应的水化物可溶于X的最简单氢化物的水溶液中
D.由W、X、Y三种元素只能组成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO47H2O晶体在加热条件下会发生分解反应:2FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
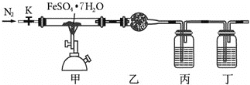
A.实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
B.乙、丙、丁中可依次盛装无水CuSO4、品红溶液、BaCl2溶液
C.还应在丁装置后面连接盛有NaOH溶液的洗气瓶
D.甲中残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com