
【题目】(1)把SO2通入盛有H2S的溶液中出现淡黄色浑浊,该反应的化学方程式为____________________。
(2)将二氧化硫通入氯化钡溶液无现象,滴入新制的氯水有白色沉淀生成,写出反应的离子方程式:_________________________。
(3)硫酸亚铁铵[(NH4)2Fe(SO4)2]隔绝空气加热至500℃时能完全分解,分解产物中含有氧化铁、二氧化硫、氨气、氮气和水蒸气,反应的化学方程式为__________________。
(4)向氯化铜溶液中通入SO2,加热生成CuCl白色沉淀,离子方程式为___________________。
(5)把氧气通入Cu与浓硫酸反应后剩余的溶液中,铜片继续溶解,反应的化学方程式为________________________________________。
(6)①磷化氢(PH3)通入盛有Fe2(SO4)3溶液的试管中,颜色由棕黄色变成淡绿色,同时还有白色蜡状固体生成,反应的离子方程式是____________________。
②PH3有剧毒,用CuSO4溶液吸收,生成物中有Cu3P、H3PO4,写出反应的化学方程式:_____________________________________。
【答案】SO2+2H2S=3S↓+2H2O Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl- 2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42- 2Cu+O2+2H2SO4=2CuSO4+2H2O 4PH3+12Fe3+=P4↓+12Fe2++12H+(或PH3+3Fe3+=P↓+3Fe2++3H+) 24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42- 2Cu+O2+2H2SO4=2CuSO4+2H2O 4PH3+12Fe3+=P4↓+12Fe2++12H+(或PH3+3Fe3+=P↓+3Fe2++3H+) 24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4
【解析】
(1)SO2与H2S反应生成淡黄色的S单质;
(2)SO2与BaCl2不反应,与新制的氯水反应生成硫酸和盐酸,硫酸与氯化钡反应生成硫酸钡沉淀;
(3)根据题意,结合质量守恒定律书写方程式;
(4)氯化铜溶液与SO2在加热时反应生成CuCl白色沉淀、SO42-、H+;
(5)在稀硫酸中加入Cu,并加热,H2SO4、Cu、O2发生氧化还原反应产生CuSO4和水;
(6)①PH3气体通入盛有Fe2(SO4)3溶液的试管中,发生氧化还原反应,产生白磷、FeSO4和硫酸;
②PH3与CuSO4在溶液中反应,生成Cu3P、H3PO4及硫酸,根据原子守恒、电子守恒,书写反应方程式。
(1)把SO2通入盛有H2S在溶液中,反应产生不溶于水的S单质和H2O,使溶液出现淡黄色浑浊,反应方程式为:SO2+2H2S=3S↓+2H2O;
(2)二氧化硫具有还原性,也具有酸性氧化物的通性,氯水能氧化SO2产生硫酸,出现白色沉淀的原因是因为硫酸与BaCl2发生复分解反应产生BaSO4和H2O,总反应的离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-;
(3)硫酸亚铁铵[(NH4)2Fe(SO4)2]隔绝空气加热至500℃时分解生成氨气、二氧化硫、氧化铁、水、N2,结合原子守恒和电子守恒配平书写化学方程式为:2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O;
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O;
(4)氯化铜溶液中通入一定量的的SO2,发生氧化还原反应生成白色沉淀CuCl,同时产生HCl、H2SO4,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
(5)Cu在金属活动性顺序表中位于H的后面,不能与稀硫酸反应,向溶液中加入氧气并加热,H2SO4、Cu、O2发生氧化还原反应产生CuSO4和水,反应的化学方程式为:2H2SO4+O2+2Cu =2CuSO4+2H2O;
(6)①PH3能将Fe3+还原成Fe2+,PH3被氧化产生P4,同时产生HCl,反应的离子方程式是4PH3+12Fe3+=P4↓+12Fe2++12H+,也可写为:PH3+3Fe3+=P↓+3Fe2++3H+;
②PH3与CuSO4在溶液中反应,生成Cu3P、H3PO4及硫酸,根据电子守恒、原子守恒,可得该反应方程式为:24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4。


科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的与间接水合法相比,气相直接水合法的优点是:___。
(2)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
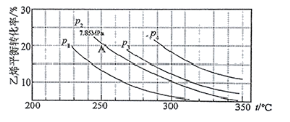
①图中压强P1、P2、P3、P4的大小顺序为:___,理由是:___。
②气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
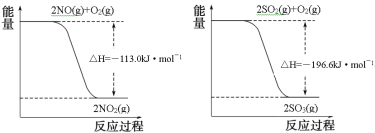
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
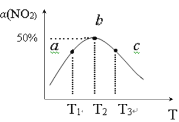
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700900℃时,O2可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
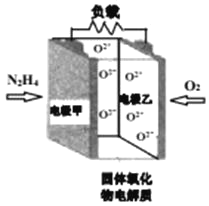
A.电池内的O2由电极乙移向电极甲
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有lmolN2H4消耗时,乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应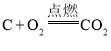 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是
(气体在同温同压下测定)
![]()
选项 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
A | 20mLH2S | 10mLSO2 | 生成黄色固体,活塞自动向内压缩 |
B | 1g薄铜片 | 10mL12mol/L浓硝酸 | 生成棕色气体、溶液呈绿色,活塞自动外移,Cu有剩余 |
C | 30mLNO2 | 10mL水(液态) | 剩有无色气体,活塞自动向内压缩 |
D | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,最终沉淀转变为红褐色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 ![]() 部分生成物和反应条件略去
部分生成物和反应条件略去![]() 。下列推断不正确的是
。下列推断不正确的是![]()
![]()
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是![]()
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:
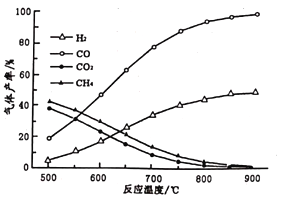
①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对含+4价硫元素的物质性质进行探究,实验方案和步骤如下:
ⅰ组 | ⅱ组 | ⅲ组 | |||
| 步骤一 | 试管 | 0.3g纯净Na2SO3(s) | 0.3g纯净Na2SO3(s)+1.17gNaCl(s) | |
滴管 | 10mL2molL-1 盐酸 | 10mL2molL-1 HNO3 | 10mL2molL-1HNO3 | ||
现象 | 均有无色气泡产生且遇空气无颜色变化 | ||||
步骤二 | 滴管 | 在上述溶液中,分别滴加4滴0.1molL-1BaCl2溶液 | |||
现象 | 4min后溶液变浑浊 | 2.5h后溶液变浑浊 | 20min后溶液变浑浊 | ||
已知Na+的存在对该实验无影响,则关于上述实验的描述,不正确的是( )
A.步骤一中产生气体的反应为SO2
B.实验ⅰ中的难溶物为BaSO3
C.由实验可知:含+4价硫元素的物质可被O2氧化
D.通过实验ⅰ和ⅲ、ⅱ和ⅲ的对比,可知:NO3-或Cl-的存在对溶液中+4价硫元素的氧化速率有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com