
����Ŀ��ijͬѧ����ˮ�ʼ��վ����480mL 0.5molL��1 NaOH��Һ�Ա�ʹ�ã�
��1����ͬѧӦѡ��mL������ƿ��
��2�������������ͼ��ʾ����ͼA����Ӧ�ڢ١���ͼ�е�����ѡ����ĸ��֮�䣮 
A.�����
B.�����
C.�����
��3����ͬѧӦ��ȡNaOH����g��
��4����2���Тݵľ��������
��5�����в�����������Һ��Ũ�ȴ�С�к�Ӱ�죿
��ת������Һ��δϴ�Ӳ��������ձ���Ũ�Ȼ����ƫ��ƫС������Ӱ�족����ͬ����
������ƿ��ԭ������������ˮ��Ũ�Ȼ� ��
���𰸡�
��1��500
��2��C
��3��10.0
��4��Һ���̶���1��2cmʱ���ý�ͷ�ιܵμ�����Һ����ʹ���̶�������
��5��ƫС����Ӱ��
���������⣺��1������480mL 0.5molL��1 NaOH��Һ��Ӧѡ��500mL����ƿ�����Դ��ǣ�500����2������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȣ�ͼAΪϴ�Ӻ�������ˮ��Ӧ����ϴ�����ý�ͷ�ιܶ��ݲ���֮�䣬
��ѡ��C����3������480mL 0.5molL��1 NaOH��Һ��Ӧѡ��500mL����ƿ��ʵ������500mL��Һ����Ҫ���ʵ�����m=0.5L��0.5mol/L��40g/mol=10.0g����4�����ݵ���ȷ����Ϊ��������ˮ��Һ���̶���1��2cmʱ���ý�ͷ�ιܵμ�����Һ����ʹ���̶������У����Դ��ǣ�10.0��Һ���̶���1��2cmʱ���ý�ͷ�ιܵμ�����Һ����ʹ���̶������У���5����ת������Һ��δϴ�Ӳ��������ձ����������ʲ�����ģ����ʵ����ʵ���ƫС����ҺŨ�Ȼ�ƫС�����Դ��ǣ�ƫС��������ƿ��ԭ������������ˮ�������ʵ����ʵ�������Һ������������Ӱ�죬��ҺŨ����Ӱ�죻���Դ��ǣ���Ӱ�죮
�����㾫������������һ�����ʵ���Ũ�ȵ���Һ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��ߣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ����������ռ��װ����ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪ1��2�������й�˵����ȷ���ǣ�˵���������ӽ���Ĥֻ����������ͨ���������ӽ���Ĥֻ����������ͨ����
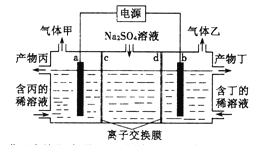
A. a�缫��ӦʽΪ��2H����2e��=H2�� B. �����Ϊ����
C. dΪ�����ӽ���Ĥ D. Na2SO4��ҺŨ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��������״̬�����ʢٸɱ� ��NaHCO3���� �۰�ˮ �ܴ����� ��FeCl3��Һ����ͭ �����ڵ�KOH ��������
�������ڵ���ʵ���___________ ,����ǿ����ʵ���_____________���ܵ������___________��
��.������һ�ֳ����ķ�ɢϵ���ش�����������
������е�����ˮ����μ���___________��Һ�����������____________��ֹͣ���ȣ����Ƶ�Fe(OH)3���壬��ȡFe(OH)3���廯ѧ��Ӧ����ʽΪ______________________________________________��
����Fe(OH)3�����м���Na2SO4������Һ������_______���ӣ������ӷ��ţ������ã�ʹ�����γ��˳�����������̽���_______________��
�����ֽ������Һ���õķ�������__________��
��.��FeCl3��Һ����ʴ��ͭ�������·��Ĺ��գ����ӷ���ʽΪ_________________________��
����ѧ������FeCl3��Һ��ȡFeCl36H2O������Ҫ��������������������ᣬ______����ȴ�ᾧ�����ˡ����˲�������©�����ձ�����Ҫʲô��������________________��
�۸�����أ�K2FeO4����һ��ǿ������������Ϊˮ��������������ز�����FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4����Ӧ�����ӷ���ʽΪ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶��µ�ˮ��Һ�У�c(H��)��10x mol/L��c(OH��)��10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ�����㣺

��1�����¶���ˮ�����ӻ�Ϊ___________
��2�����¶��£�0.01 mol/L��NaOH��Һ��pHΪ___________
��.��֪25 ��ʱ��Ka(CH3COOH)��1.6��10��5��
��1����0.1 mol��L��1������Һ�м���һ����1 mol��L��1����ʱ����ʽ�е���ֵ�Ƿ����仯________(���ǻ��)����ԭ��______________________
��2�����������ʼŨ��Ϊ0.010 mol��L��1��ƽ��ʱc(H��)=______________
��. ��֪���³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH��5.60,c(H2CO3)��6.25��10��5mol��L��1��
������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3 ![]() HCO
HCO![]() ��H����ƽ�ⳣ��K1��________��(��֪10��5.60��2.5��10��6)
��H����ƽ�ⳣ��K1��________��(��֪10��5.60��2.5��10��6)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������л������
A. �Ȼ��� B. ������̼ C. ̼������ D. �Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L��1�������ͬ������ʹ���������Һ��˵����ȷ����
A.�кͼ��������ͬB.ˮ�ĵ���̶���ͬ
C.OH�������ʵ���Ũ����ͬD.H�������ʵ���Ũ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���AgCl������Һ�м�ˮ������������ȷ����
A.AgCl���ܽ�ȼ�СB.AgCl���ܽ������Ksp����
C.c(Ag��)����D.AgCl���ܽ�ȡ�Ksp������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L���ܱ������г���һ������H2O��CO��ά��700�淢����Ӧ��CO(g) + H2O(g)![]() CO2(g) + H2(g)����Ӧ�����вⶨ�IJ������ݼ��±�(����t1<t2)��
CO2(g) + H2(g)����Ӧ�����вⶨ�IJ������ݼ��±�(����t1<t2)��
��Ӧʱ��/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
����˵����ȷ����
A. ��Ӧ��t1 min�ڵ�ƽ������Ϊv(H2)��0.40/t1 mol��L��1��min��1
B. �����������䣬��ʼʱ�����г���0.60molCO��1.20 molH2O����ƽ��ʱ��n(CO2)��0.40 mol
C. ���������������䣬��ƽ����ϵ����ͨ��0.20 molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O�����������С
D. ���¶�����800�棬������Ӧ��ƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2��3H2![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��( )
2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��( )

A. N2(g)��3H2(g) ![]() 2 NH3(l) ��H��(b��c��a) kJ��mol��1
2 NH3(l) ��H��(b��c��a) kJ��mol��1
B. N2(g)��3H2(g) ![]() 2NH3(g) ��H��(a��b) kJ��mol��1
2NH3(g) ��H��(a��b) kJ��mol��1
C. N2(g)��3H2(g) ![]() 2NH3(l) ��H��2(a��b��c) kJ��mol��1
2NH3(l) ��H��2(a��b��c) kJ��mol��1
D. N2(g)��3H2(g) ![]() 2NH3(g) ��H��2(b��a) kJ��mol��1
2NH3(g) ��H��2(b��a) kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com