
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
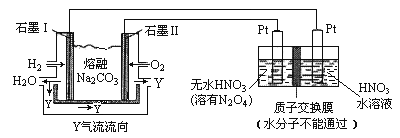
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________
【答案】N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1 ①②④ 吸热 1.8 < H2+CO32--2e-=CO2+H2O N2O4+2HNO3-2e-=2N2O5+2H+
【解析】
(1)由H=反应物总能量-生成物总能量,可知![]() 与
与![]() 反应合成
反应合成![]() 的热化学方程式;
的热化学方程式;
(2)化学反应平衡的两大标志为“等”,“定”, “等”正逆反应速率相等(可解读为1.反应物的消耗量和生成物的消耗量等于反应系数比;2.反应物断键和生成物断键或反应物成键和生成物成键数目为一定比例),“定”指反应中变化的量不在变化;
(3)反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,可以得知反应向生成二氧化氮的方向移动,将勒夏特列原理可以得知反应为放热;
(4)装置中左侧为熔融碳酸盐做电解质的燃料电池装置为右侧的装置提供外部电源,右侧工作原理为电解池原理;
(1)拆开1molH-H键,1moLN-H键,1moN≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为![]() ,依据化学方程式计算反应热为△H=946kJ/mol+3×436kJ/mol+6×391kJ/mol=-92KJ/mol,故反应的热化学方程式为:
,依据化学方程式计算反应热为△H=946kJ/mol+3×436kJ/mol+6×391kJ/mol=-92KJ/mol,故反应的热化学方程式为:![]() ,△H=-92KJ/mol;
,△H=-92KJ/mol;
(2)①单位时间内生成2n mol![]() 的同时消耗3nmol
的同时消耗3nmol![]() ,于此同时生成3n mol
,于此同时生成3n mol![]() ,故可知①可以作为达成平衡的标志;
,故可知①可以作为达成平衡的标志;
②单位时间内生成6n mol ![]() 键的同时消耗nmol
键的同时消耗nmol![]() ,此时生成n mol
,此时生成n mol![]() 键故②可以作为达成平衡的标志;
键故②可以作为达成平衡的标志;
③![]() 的物质的量浓度之比为1∶3∶2,并不能说明物质的量浓度不变,故③不能作为达成平衡的标志;
的物质的量浓度之比为1∶3∶2,并不能说明物质的量浓度不变,故③不能作为达成平衡的标志;
④![]() ,由反应式可知质量为定值,
,由反应式可知质量为定值,![]() 为变化的值,故
为变化的值,故![]() 不变可以作为达成平衡的标志;
不变可以作为达成平衡的标志;
⑤容器内的气体密度![]() ,
,![]() 为定值,
为定值,![]() 为定值,故容器内的气体密度不变不能作为达成平衡的标志;
为定值,故容器内的气体密度不变不能作为达成平衡的标志;
选①②④;
(3)①2对于![]() ,反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,说明平衡正向进行,则正反应为吸热反应;
,反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,说明平衡正向进行,则正反应为吸热反应;
②.该温度下2L密闭容器中充入0.40mol![]() 结合三段式得到
结合三段式得到
![]()
起始量(mo/L) 0.2 0
变化量(mo/L) 0.15 0.3
平衡量(mol/L) 0.05 0.3
平衡常数K= ![]() =
=![]() =1.8;
=1.8;
③. ![]()
起始量(mol) 0.4 0
全部转化 0 0.8
则相同温度下,若开始向该容器中充入0.80mol![]() ,则达到平衡后和充入0.4mol四氧化二氮达到相同的平衡状态,故c(NO2)=0.3mol/L,所以 c(NO2)小于 0.60mol·L-1;
,则达到平衡后和充入0.4mol四氧化二氮达到相同的平衡状态,故c(NO2)=0.3mol/L,所以 c(NO2)小于 0.60mol·L-1;
(4).①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,故电极反应式为:H2+CO32--2e-=CO2+H2O;②![]() 中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成
中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成![]() ,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为:N2O4+2HNO3-2e-=2N2O5+2H+。
,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为:N2O4+2HNO3-2e-=2N2O5+2H+。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
a.锌跟足量稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量
b.镀层破损后,白铁![]() 镀锌的铁
镀锌的铁![]() 比马口铁
比马口铁![]() 镀锡的铁
镀锡的铁![]() 更易腐蚀
更易腐蚀
c.电镀时,应把镀件置于电解槽的阴极
d.冶炼铝时,可以电解熔融态的![]()
e.钢铁表面常易锈蚀生成![]()
A.abcdeB.acdeC.ceD.bd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
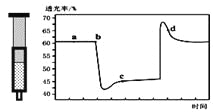
A. b点的操作是压缩注射器
B. c点与a点相比,c(NO2)增大,c(N2O4)减小
C. d 点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7.向m mL0.1mo1L-1H2SO3溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是( )
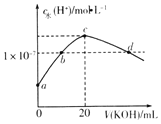
A.m=20
B.c点对应的溶液中存在c(K+)=c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH-的Kb=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:
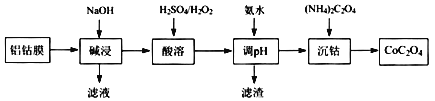
回答下列问题:
(l) Li元素在元素周期表中的位置为____________,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100 mL l.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要_________。
(6)取CoC2O4固体4.41 g在空气中加热至300℃,得到钴的氧化物2.41 g,则该反应的化学方程式为 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com