
【题目】常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7.向m mL0.1mo1L-1H2SO3溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是( )
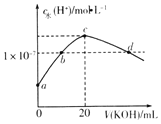
A.m=20
B.c点对应的溶液中存在c(K+)=c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH-的Kb=1×10-7
【答案】D
【解析】
A.mmL0.1mol/LH2S溶液中滴加0.1mol/LKOH溶液20mL,恰好反应生成K2S,溶液显碱性,消耗H2S体积m=10mL,故A错误;
B.c点时水的电离程度最大,K2S水解促进水的电离,c点恰好反应生成K2S,此时溶液为碱性,溶液中存在电荷守恒:c(K+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),由于c(H+)<c(OH-),则c(K+)>c(HSO3-)+2c(SO32-),故B错误;
C.b、d点水电离出氢离子1×10-7mol/L,b点为中性溶液,所以b点pH=7,d点为硫化钾和氢氧化钾的混合液,溶液显碱性,pH>7,故C错误;
D.常温下,SO32-+H2OHSO3-+OH--的Kb=![]() =1×10-7,故D正确,
=1×10-7,故D正确,
故选:D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
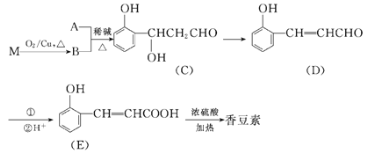
【题目】香豆素是一种用途广泛的香料,可用于配制香精以及制造日用化妆品和香皂等。以有机物M和有机物A合成香豆素的流程如下:
已知以下信息:
①(CH3)3CCHO+CH3CHO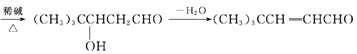
②M的分子式为C2H6O,分子中有3种化学环境不同的氢原子
③香豆素中含有两个六元环
(1)由M生成B的化学方程式为___。
(2)A的结构简式为___。
(3)由E生成香豆素的化学方程式为___。
(4)写出满足如下条件的C的一种同分异构体的结构简式:__。
①能发生银镜反应 ②1molC完全反应能消耗2molNaOH
③苯环上有3个取代基 ④苯环上的一氯代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断不正确的是
①若NaA、NaB溶液的pH分别为9和8,则酸性一定是![]() ;
;
②![]() 溶液蒸干得
溶液蒸干得![]() 固体,
固体,![]() 溶液蒸干得
溶液蒸干得![]() 固体;
固体;
③![]() 水解产生
水解产生![]() 和
和![]() ,向水解液中加入少量冰醋酸会因其中和
,向水解液中加入少量冰醋酸会因其中和![]() 而使水解平衡右移;
而使水解平衡右移;
④中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同;
⑤因![]() ,为抑制水解,配制
,为抑制水解,配制![]() 溶液时需将
溶液时需将![]() 溶解在稀
溶解在稀![]() 中.
中.
A.只有①②B.只有②③⑤C.只有①②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL0.1molL—1NaOH溶液中逐滴加入0.1molL-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
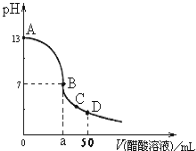
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
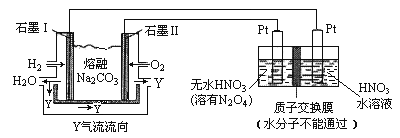
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙利度胺是一种重要的合成药物,具有镇静、抗炎症等作用。有机物H是合成它的一种中间体,合成路线如图(部分反应条件和产物未列出)。
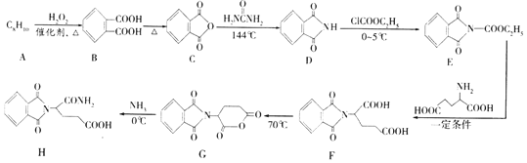
回答下列问题:
(1)A的化学名称为______,E→F的反应类型为______,H中官能团的名称为______。
(2)判断化合物F中有______个手性碳原子。D→E的反应方程式为______。
(3)写出符合下列条件的B的同分异构体______(写出一种即可,不考虑立体异构)
①能与FeC13溶液发生显色反应
②1mol该化合物能与4mol[Ag(NH3)2]OH反应
③其核磁共振氢谱显示有4种不同化学环境的氢
(4)结合上述流程中的信息,写出以1,4-丁二醇为原料制备化合物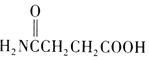 的合成路线(其他试剂任选)______。
的合成路线(其他试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
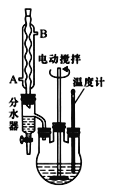
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得(已知苯甲酸的酸性强于碳酸),反应装置如图(部分装置省略),反应原理如下:
 +C2H5OH
+C2H5OH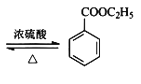 +H2O
+H2O
实验操作步骤:
①向三颈烧瓶内加入12.2 g苯甲酸、25 mL乙醇、20 mL苯及4 mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210—213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8 mL。
可能用到的有关数据如下:
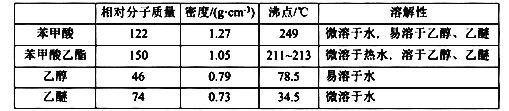
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______
(2)步骤①中加浓硫酸的作用是________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是__________。
(4)步骤③中加入碳酸钠的目的是____________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)蒸馏操作中温度计水银球的位置应为下图中________(填a、b、c、d)所示。
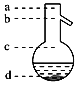
(7)本实验所得到的苯甲酸乙酯产率______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为![]() 的是
的是![]()
![]()
A.液面在“0”刻度时,![]() 碱式滴定管和
碱式滴定管和![]() 碱式滴定管所盛液体的体积
碱式滴定管所盛液体的体积
B.相同温度下,![]() 醋酸溶液和
醋酸溶液和![]() 醋酸溶液中的
醋酸溶液中的![]()
C.在![]() 溶液中,
溶液中,![]() 与
与![]()
D.相同温度下,等浓度的![]() 和NaOH溶液,前者与后者的
和NaOH溶液,前者与后者的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com