
【题目】下列叙述正确的是![]()
a.锌跟足量稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量
b.镀层破损后,白铁![]() 镀锌的铁
镀锌的铁![]() 比马口铁
比马口铁![]() 镀锡的铁
镀锡的铁![]() 更易腐蚀
更易腐蚀
c.电镀时,应把镀件置于电解槽的阴极
d.冶炼铝时,可以电解熔融态的![]()
e.钢铁表面常易锈蚀生成![]()
A.abcdeB.acdeC.ceD.bd
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。
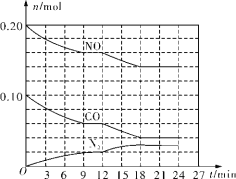
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________(填字母代号)。
a.充入水蒸气稀释反应物 b.加入NO c.加催化剂 d.增大压强
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是一种用途广泛的香料,可用于配制香精以及制造日用化妆品和香皂等。以有机物M和有机物A合成香豆素的流程如下:
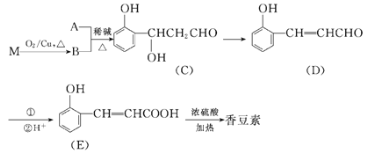
已知以下信息:
①(CH3)3CCHO+CH3CHO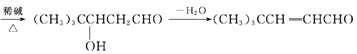
②M的分子式为C2H6O,分子中有3种化学环境不同的氢原子
③香豆素中含有两个六元环
(1)由M生成B的化学方程式为___。
(2)A的结构简式为___。
(3)由E生成香豆素的化学方程式为___。
(4)写出满足如下条件的C的一种同分异构体的结构简式:__。
①能发生银镜反应 ②1molC完全反应能消耗2molNaOH
③苯环上有3个取代基 ④苯环上的一氯代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在化工领域有重要的作用:
(1)以铁为催化剂,![]() mol氮气和
mol氮气和![]() mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为
mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为![]() mol。
mol。
①该条件下氮气的转化率是______,该温度下![]() 的化学平衡常数是______
的化学平衡常数是______![]() 保留小数点后两位
保留小数点后两位![]() 。
。
②在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时![]() 的总转化率为
的总转化率为![]() 氮气的转化率减小的原因是______。
氮气的转化率减小的原因是______。
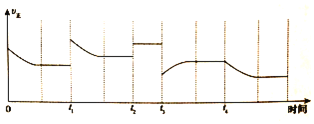
③合成氨反应:![]()
![]() ,在反应过程中只改变一个条件,正反应速率的变化如图所示:
,在反应过程中只改变一个条件,正反应速率的变化如图所示:![]() 时改变的条件是______;
时改变的条件是______;![]() 时改变的条件是______。
时改变的条件是______。
(2)①![]() 是一种高能燃料,有强还原性,可通过
是一种高能燃料,有强还原性,可通过![]() 和NaClO反应制得,写出该制备反应的化学方程式______。
和NaClO反应制得,写出该制备反应的化学方程式______。
②N2H4的水溶液呈弱碱性,室温下其电离常数![]() ,则
,则![]()
![]() 水溶液的pH等于______
水溶液的pH等于______![]() 忽略
忽略![]() 的二级电离和
的二级电离和![]() 的电离
的电离![]() 。
。
③已知298K和101kPa条件下:
![]()
![]()
![]()
![]()
则![]() 的燃烧热
的燃烧热![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是
A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B.由N2O4(g)![]() 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ
D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
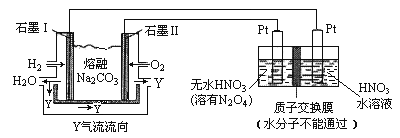
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com