
【题目】下列有关热化学方程式的叙述,正确的是
A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B.由N2O4(g)![]() 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ
D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ
【答案】D
【解析】
A.燃烧热指的是1mol的可燃物完全燃烧生成稳定的氧化物时所放出的热量,而对于水来讲,液态的水才是稳定的状态,A错误;
B.N2O4(g)![]() 2NO2(g) △H=-56.9kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9kJ的热量,但这是一个可逆反应,完全反应是不可能的,因此B错误;
2NO2(g) △H=-56.9kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9kJ的热量,但这是一个可逆反应,完全反应是不可能的,因此B错误;
C.一般来讲,中和热是指稀的强酸与稀的强碱反应生成1mol水的时候所放出的热量,但是对于醋酸来讲,是弱电解质,电离的过程要吸收热量,因此1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量要小于57.3 kJ,C错误;
D.碳完全燃烧时,生成的是二氧化碳,肯定比生成一氧化碳时放出的热量要多,D正确。
故答案选D。


科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
a.锌跟足量稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量
b.镀层破损后,白铁![]() 镀锌的铁
镀锌的铁![]() 比马口铁
比马口铁![]() 镀锡的铁
镀锡的铁![]() 更易腐蚀
更易腐蚀
c.电镀时,应把镀件置于电解槽的阴极
d.冶炼铝时,可以电解熔融态的![]()
e.钢铁表面常易锈蚀生成![]()
A.abcdeB.acdeC.ceD.bd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)先配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g,
需要的主要玻璃仪器有玻璃棒、量烧杯、胶头滴管、量筒和___________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手控制滴定管活塞,右手摇动锥形瓶,眼睛____________;
滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:___________,即到终点,读出体积并记录数据。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a.滴定管在盛装标准NaOH溶液前未润洗
b.在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c.达到滴定终点时,俯视溶液凹液面最低点读数
d.滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f.滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________。(结果保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1该反应进行的快慢顺序为( )
2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1该反应进行的快慢顺序为( )
A.④>②=③>①B.④>②>③>①
C.①>②=③>④D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
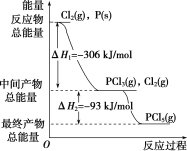
根据如图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________________________________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是_____________________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=____,P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
(4)已知1mol白磷变成1mol红磷放出18.39KJ的热量和下列两个热化学方程式:
4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1,
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系正确的是(______)
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
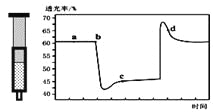
A. b点的操作是压缩注射器
B. c点与a点相比,c(NO2)增大,c(N2O4)减小
C. d 点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com