
【题目】下列说法正确的是
A. Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强
B. 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
C. 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质[
D. 钠与氧气反应的产物与反应条件无关
【答案】A
【解析】试题分析:A.同一周期元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,Si、P、S、Cl的非金属性逐渐增强,所以其相应的最高价氧化物对应水化物的酸性依次增强,故A正确;B.硅元素在自然界中只能以化合态存在,Si单质为半导体,纯净的硅晶体可用于制作计算机芯片,故B错误;C.活泼金属采用电解其熔融盐或氧化物的方法冶炼,较不活泼金属采用热氧化还原法冶炼,所以Na采用电解熔融氯化钠的方法冶炼,Fe、Cu采用热还原法冶炼,故C错误;D.4Na+O2=2Na2O、2Na+O2![]() Na2O2,所以反应条件不同其产物不同,故D错误;故选A。
Na2O2,所以反应条件不同其产物不同,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法正确的是( )
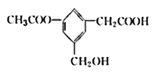
A. 分子中含有4种官能团
B. 1mol该物质可以和3molNaOH反应
C. 在水溶液中该有机物中的羟基和羧基均能电离出氢离子
D. 可发生加成反应、中和反应、水解反应、酯化反应、氧化反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是
![]() (b)、
(b)、![]() (d)、
(d)、![]() (p)
(p)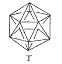
A.b、d和p互为同分异构体B.分子丁显然是不可能合成的
C.b、d、p均可与酸性高锰酸钾溶液反应D.b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本冈山大学教授滨田博喜和研究员富良德等通过实验发现,桉树叶子的培养细胞能够消除有害化学物质双酚A的毒性。双酚A的结构简式如下图所示,下列有关此物质的说法正确的是( )

A. 1 mol该物质与足量溴水反应消耗2 mol Br2
B. 该物质能与碳酸氢钠溶液反应放出CO2
C. 该物质的所有碳原子可能在同一平面
D. 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
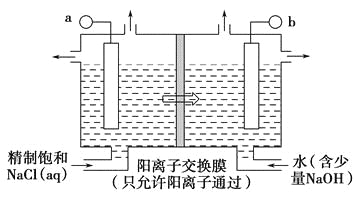
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学中的反应类型较多,请写出下列反应类型。
①苯与浓硝酸共热生成硝基苯__________
②乙醛和新制的银氨溶液反应__________
③乙烯使溴的四氯化碳溶液褪色________
④溴乙烷和氢氧化钠的乙醇溶液共热________
⑤由乙炔制备聚乙炔_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
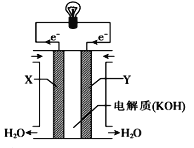
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的_____极,OH—向______(填“正”或“负”)极作定向移动,Y极的电极反应方程式为________,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是_______ L。
(2)为了验证Fe3 +与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是__________。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置验证同主族元素非金属性的变化规律。回答下列问题:

(1)仪器A的名称为_______,干燥管D的作用是________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,实验时观察到C溶液中现彖为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加______(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com