
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42﹣和Cr2O72﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种
方法1:还原沉淀法,其中第①步存在平衡步存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显 .
(2)写出第③步的离子反应方程式: .
(3)第②步中,用6mol的FeSO47H2O可还原molCr2O72﹣离子.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3() Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 .
方法2:电解法:该法用Fe做电极电解含Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)写出阳极的电极反应式 .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为 .
【答案】
(1)黄色
(2)Cr3++3OH﹣=Cr(OH)3↓
(3)1
(4)s,5
(5)Fe﹣2e﹣=Fe2+
(6)2H++2e﹣=H2↑
(7)Zn2++2e﹣=Zn
【解析】解:(1)c(OH﹣)增大,平衡2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O左移,溶液呈黄色,
所以答案是:黄;(2)第③步Cr3+与氢氧根离子结合生成沉淀,其反应的离子方程式为:Cr3++3OH﹣=Cr(OH)3↓;所以答案是:Cr3++3OH﹣=Cr(OH)3↓;(3)用6mol的FeSO47H2O作还原剂,转移6mol电子,则可以还原1mol Cr2O72﹣离子;所以答案是:1;(4)Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32,要使c(Cr3+)降至10﹣5mol/L,则需c(OH﹣)= ![]() =
= ![]() =10﹣9mol/L,所以c(H+)=10﹣5mol/L,即pH=5,所以答案是:5;(5)在电解法除铬中,铁作阳极,阳极反应为Fe﹣2e﹣═Fe2+,以提供还原剂Fe2+,
=10﹣9mol/L,所以c(H+)=10﹣5mol/L,即pH=5,所以答案是:5;(5)在电解法除铬中,铁作阳极,阳极反应为Fe﹣2e﹣═Fe2+,以提供还原剂Fe2+,
所以答案是:Fe﹣2e﹣=Fe2+;(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e﹣═H2↑;
所以答案是:2H++2e﹣=H2↑;(7)电镀时阴极上溶液中金属离子得电子得到金属单质,则用电镀法在铁制品上镀上一层锌,则阴极上锌离子得电子生成Zn,其电极反应式为Zn2++2e﹣=Zn;
所以答案是:Zn2++2e﹣=Zn.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. Ⅰ.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s) ![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品.
回答问题: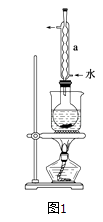
(1)硫粉在反应前用乙醇润湿的目的是 .
(2)仪器a的名称是 , 其作用是 .
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 . 检验是否存在该杂质的方法是 .
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: .
(5)Ⅱ.测定产品纯度 准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0molL﹣1碘的标准溶液滴定.
反应原理为2S2O ![]() +I2═S4O
+I2═S4O ![]() +2I﹣
+2I﹣
滴定至终点时,溶液颜色的变化:
(6)测定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为mL.产品的纯度为(设Na2S2O35H2O相对分子质量为M) . 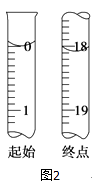
(7)Ⅲ.Na2S2O3的应用 Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ![]() ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求答题:
(1)(CH3)2CHCH(CH3)CH2CH3的系统命名是
(2)写出苯与液溴发生取代反应的化学方程式:
(3)某烃A的相对分子质量为84,能与氢气发生加成反应.A的一氯取代产物只有一种,则A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2O 的质量是18 g/mol B. CH4 的摩尔质量是16 g
C. 1mol/LMgCl2溶液中含有Cl﹣的数目为2NA D. 3.01×1023个O2分子的质量是16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图两种化合物的结构或性质描述正确的是( ) 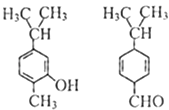
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( ) 
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn
C.若两电极都是金属,则它们的活动性为 X>Y
D.X 极上发生的是还原反应,Y 极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化学试剂。某实验小组的同学利用浓硫酸进行如下实验。请按要求回答下列问题。
I.制取二氧化硫并探究其性质

(1)装置A中发生反应的化学方程式为___________。上述装置中适于收集二氧化硫的气体是(填字母)____。
(2)将一收集满二氧化硫气体的小试管倒置于滴有紫色石蕊溶液的水中,可观察到的现象是____。
(3)上述实验所产生的二氧化硫尾气可选用E装置来吸收,该反应的化学方程式为_________。
II.处理含正六价铬的废水样液(+6价Cr的含量为78mg/L)。实验步骤如下:
①取1L废水加入一定量1.8mol/LH2SO4溶液使样液酸化
②加入一定量的绿矾(FeSO4·7H2O),将正六价铬转化为正三价铬离子
③加入过量的石灰水,使正三价的铬离子转化为Cr(OH)3沉淀
④过滤,除去沉淀物
(1)配制步骤①中所需的H2SO4溶液l00mL,需用18mol/L H2SO4溶液的体积是______mL。
(2)步骤②中反应的离子方程式为14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O,此反应中氧化剂和还原剂物质的量之比为__________。
(3)处理1L该废水样液至少需用绿矾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( ) 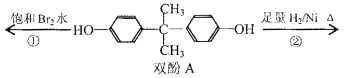
A.双酚A的分子式是C15H16O2
B.反应①中,1mol双酚A最多消耗2mol Br2
C.反应②的产物中只有一种官能团
D.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com