
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ,故答案为:
,故答案为: ;
;
| ||
| ||
| ||
| ||


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、② | B、③④ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C、CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
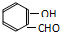 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( 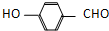 )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )| A、前者>后者 | B、前者<后者 |
| C、前者=后者 | D、无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d<c<a<b |
| B、c<d<b<a |
| C、d<a<b<c |
| D、c<d<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2与稀H2SO4反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、饱和碳酸钠溶液中通入足量CO2 CO32-+H2O+CO2═2HCO3- |
| C、C12与NaOH溶液反应 Cl2+2OH-═C1-+C1O-+H2O |
| D、把金属铁放入稀硫酸中 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com