
【题目】常温下0.1 mol·L-1二元酸H2A的溶液中含A粒子的物质的量分数与pH的关系如图所示。该温度下,下列说法正确的是

A. H2A的第一步电离方程式为H2A![]() HA-+H+
HA-+H+
B. NaHA溶于水能促进水的电离
C. H2A的第二步电离常数Ka2=1.0×10-3
D. 0.1 mol·L-1 Na2A溶液中存在c( A2-)>c(HA-)>c(OH- )>c(H+)
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】【2015上海卷】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
1.第①步反应的化学方程式为 。第②步反应的化学方程式为 。
2.可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
3.检验CaO2·8H2O是否洗净的方法是 。
4.CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
5.已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸收能量的化学反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化镁具有优良的性能,广泛应用于各种材料。以某厂工业废液(主要成分为MgCl2,含有少量Fe2+、Fe3+、Mn2+等)为原料制备高纯氧化镁的流程如下:

若要求产品尽量不含杂质,而且生产成本较低,请根据下表提供的数据作答。
25℃时,生成氢氧化物沉淀的pH | 原料价格表 | ||||
物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 价格/(元·吨-1) | |
Mg(OH)2 | 10.0 | 11.0 | 漂液(含25.5% NaClO) | 450 | |
Mn(OH)2 | 8.3 | 9.8 | 双氧水(含30% H2O2) | 2400 | |
Fe(OH)2 | 7.6 | 9.6 | 烧碱(含98% NaOH) | 2100 | |
Fe(OH)3 | 2.7 | 3.7 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)漂液中NaClO的电子式为_________________;双氧水中H2O2的结构式为___________。
(2)25℃时,Ksp[Mg(OH)2]=_____________。
(3)“氧化”时,所加试剂X的最佳选择为________________,该步反应的离子方程式为____________。
(4)试剂Y的俗称为__________;“调节pH=9.8”的目的为___________________。
(5)“煮沸”时,反应的化学方程式为_______________________。
(6)常温下,取一定量的试剂Z,加水稀释成1.0 L 0.2 mol·L-1的溶液;再向其中缓慢通入0.05 mol气体A充分反应后,所得溶液中各离子浓度由大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
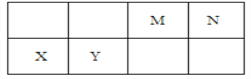
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com