
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
【答案】 3d104s1 N>C>Si sp2杂化 CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol ![]() 30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
【解析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加,C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色,则C为Na;A原子核外电子有6种不同的运动状态,A为碳元素;B的原子序数介于碳、氧之间,则B为N元素;E的基态原子最外层电子排布式为3s23p2,则E为Si;D原子最外层电子数等于电子层数,原子序数介于E和C之间,则D是Al;F与C位于不同周期,F处于第四周期,F原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则F为Cu。
(1)铜原子的基态原子核外价电子排布式是3d104s1;(2)非金属性越强,电负性越大,则A、B、E三种元素电负性由大到小排列顺序为N>C>Si;(3)根据结构可知类似于石墨的的层状结构,则N原子的杂化类型为sp2杂化。(4)已知:①、CH4(g)+2 NO2(g)= N2(g)+CO2(g)+2H2O (g) △H1=-867kJ/mol,②、2NO2(g)N2O4(g)△H2=-56.9kJ/mol,由盖斯定律,①-②得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol;(5)Al单质为面心立方晶体,晶胞中含有铝原子的个数是4,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,则其单质的密度为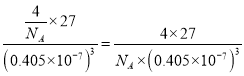 g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。
g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。


科目:高中化学 来源: 题型:
【题目】填空:
I. 某有机物由C、H、O三种元素组成,球棍模型如图所示:

(1)该有机物的分子式是_____________;
(2)该有机物所含官能团的名称是_____________;
(3)该有机物可以发生加聚反应,其产物的结构简式是_____________;
(4)下列有关该有机物的描述中,正确的是_____________(填序号)。
a. 能与NaHCO3溶液反应 b. 能发生水解反应
c. 不能与溴的CCl4溶液反应 d. 能与酸性高锰酸钾溶液反应
II. 实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | ______________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是__________ | ______________ |
③ | 乙炔 | 电石与饱和食盐水反应 | ______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去各组物质中的少量杂质正确的是( )
A. 苯中的甲苯(溴水) B. 乙酸乙酯中的乙酸(NaOH溶液)
C. 乙烷中的乙烯(酸性高锰酸钾溶液) D. 乙醇中的水(新制的CaO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红宝石的主要成分是氧化铝,氧化铝是一种( )
A.红色、难熔、难溶于水的固体B.白色、易熔、难溶于水的固体
C.白色、难熔、易溶于水的固体D.白色、难熔、难溶于水的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1 mol·L-1二元酸H2A的溶液中含A粒子的物质的量分数与pH的关系如图所示。该温度下,下列说法正确的是

A. H2A的第一步电离方程式为H2A![]() HA-+H+
HA-+H+
B. NaHA溶于水能促进水的电离
C. H2A的第二步电离常数Ka2=1.0×10-3
D. 0.1 mol·L-1 Na2A溶液中存在c( A2-)>c(HA-)>c(OH- )>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被严重腐蚀了的铜和铁共同放入盐酸中充分反应后,剩余残渣中只有铜,则溶液中含有的金属阳离子为( )
A. 一定只含有Fe2+ B. 可能只含Cu2+
C. 一定有Fe2+和Cu2+ D. 可能有Cu2+和Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。

下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH═CHR2,被氧化为![]() 和
和![]() ;
; 被氧化为
被氧化为 和
和 ,由此推断分子式为C5H10的烯烃的氧化产物有( )
,由此推断分子式为C5H10的烯烃的氧化产物有( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com