
【题目】实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是____________(填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。
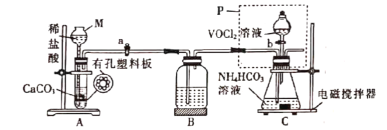
①仪器M的名称是___________,实验开始前的操作是_________。
②装置B的作用是__________________。
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用无水乙醇洗涤的目的是_______________。
④称量mg产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为VO2++Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________(填“偏高”、“偏低”或“无影响”),产品中钒的质量分数为_________(以VO2+的量进行计算,列出计算式)。
【答案】N2H4·2HCl 长颈漏斗 检查装置的气密性 除去二氧化碳气体中的氯化氢 除去晶体表面的水 偏高 ![]()
【解析】
根据合成氧钒(Ⅳ)碱式碳酸铵晶体流程,将V2O5通过盐酸、N2H4·2HCl的作用,还原为VOCl2,得到的VOCl2与碳酸氢铵溶液同时搅拌将得到氧钒(Ⅳ)碱式碳酸铵晶体;VOCl2转化为氧钒(Ⅳ)碱式碳酸铵晶体的过程如装置图所示,向反应体系中持续通入CO2,CO2溶于水生成碳酸,碳酸电离生成氢离子抑制了铵根离子的水解,保证氧钒(Ⅳ)碱式碳酸铵产率的最大化,反应完成后,将得到的晶体经洗涤、过滤、干燥得到较纯晶体,通过滴定的方法测定晶体中V的含量,据此分析。
(1)反应过程中稀盐酸起到酸性的作用,N2H4·2HCl在反应中起到还原剂的作用;
(2)①根据图示装置,仪器M为长颈漏斗;实验开始前要检查装置的气密性;
②装置B的作用是除去制备的二氧化碳气体中含有氯化氢气体,否则氯化氢与碳酸氢铵会发生反应,降低晶体产率;
③乙醇能与水互溶,利用乙醇具有挥发性可以除去晶体表面的水分;
④若(NH4)2Fe(SO4)2标准溶液部分变质,则还原能力降低,滴定时消耗的标准溶液的体积偏高,会使测定结果偏高;根据滴定反应VO2++Fe2++2H+=VO2++Fe3++H2O,钒元素的物质的量n=n[(NH4)2Fe(SO4)2]=cmol/L×V×10-3L=cV×10-3mol,产品中钒(以VO2+计)的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某固体中可能含有K+、NH4+、Mg2+、Fe3+、Ba2+、Cu2+、Cl-、SO42-、HCO3-中的几种,填写下列空白:
(1)将该固体溶于水后得无色澄清溶液,由此现象得出该固体中一定不存在的离子是___;
(2)将所得无色澄清溶液进行检测,实验步骤及现象如图:

图中实验中得到的两种气体分别是___、___;白色沉淀成分是___ (填化学式);加入足量盐酸生成气体的离子方程式为___;该固体中可能存在的离子是___;
(3)通过以上检测,下列说法正确的是___
A.该固体中可能含有(NH4)2SO4、KHCO3
B.该固体中可能含有K2SO4、NH4HCO3,一定不含KCl
C.该固体中可能含有(NH4)2SO4、KCl,一定不含KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
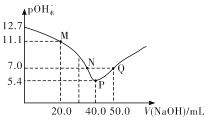
A.水的电离程度:M>PB.图中P点至Q点对应溶液中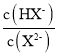 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H= -a kJ·mol-1
2CO2(g)+N2(g) H= -a kJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H= + 489.0 kJ/mol
②C(s)+CO2(g)=2CO(g)△H= + 172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。
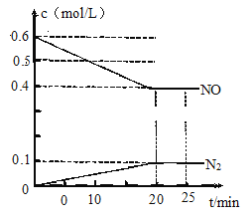
0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将_________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为_________(结果保留两位有效数字)
(5)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH![]() ):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”),理由是____________________(用离子方程式表示)。
(2)在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________(填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是
A.CH2=CH—CH=CH2 1,3-二丁烯
B.CH3CH2CH(CH3)OH 2-甲基-1-丙醇
C.![]() 2-甲基-3-丁炔
2-甲基-3-丁炔
D.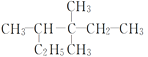 3,3,4-三甲基己烷
3,3,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的 CO、 NO2 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气 体,反 应方程式为4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是
4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
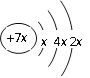 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为________________。
(2) NH3和H2O中稳定性较高的是:___________,NH3和PH3中沸点较高的是:__________。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

①装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为_______________________________________。
②乙装置中a极上的电极反应式为___________________。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4________mL(标准状况),乙装置中所得溶液的pH=________(忽略电解前后溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com